コミュニケーション/毒性学トピックス解説
毒性学総論
毒性学的観点から見た生体必須微量元素セレンの代謝
セレンは、元素の周期表で第16族に含まれ、酸素の2つ下、硫黄の1つ下、テルルの1つ上に位置する元素です。そのため、物理化学的性質は硫黄に類似しています。セレンの生物学的特徴としては、動物にとって健康を維持する上で欠くことのできない元素ですが、体内での存在量は極めて微量です。日本人の食事摂取基準(2020年版)によりますと、成人男性の推奨量(ほとんどの人が必要量を満たすと推定される1日あたりの摂取量)は、わずか30 µgです1)。
セレンを体内に貯蔵するプールはほとんどないとされていますので、必要な量を摂取しないと、すぐに欠乏症を起こしてしまいます2)。セレンの欠乏症状として、爪変形や脱毛、そして重篤な場合は心筋症を起こし、死に至ることもあります。しかし、平均的な食生活を送る日本人では、食事中から十分なセレンを摂取していますので、セレン欠乏症になることはありません。なお、植物ではセレンの必須性は確かめられていませんが、ニンニクのようなユリ科ネギ属、アブラナ科のブロッコリーなどは、硫黄の代謝経路を活用し、セレンに対する高い代謝能を持った植物として知られています3)。
セレンは遷移金属と思われがちですが、典型元素(非金属元素)の性質を併せ持つ半金属元素とも言われ、生体内では共有結合性の化合物を形成して、代謝されます。セレンを必須としない植物では、例外はありますが、セレンは硫黄の代謝経路に乗って代謝されることが知られています。一方、セレンを必須元素とする動物では、硫黄とセレンを見分けて代謝することが知られています。セレンに最も特徴的な代謝経路は尿中排泄に至る過程です。セレンの生理的な摂取量の範囲では、動物はセレンを1β-methylseleno-N-acetyl-D-galactosamineという糖の誘導体(一般的にセレン糖と呼ばれています)として尿中に排泄します4)(図)。この代謝物はセレンに特徴的で、硫黄や非必須元素であるテルルでは、同じように糖の形をした尿中代謝物を生成することはありません。なぜセレンの尿中代謝物が糖の誘導体なのか、そして糖の中でもN-アセチルガラクトサミンが使われるのかは、未だに明らかになっていません。
セレンの摂取量が過剰になり、栄養所要量を上回るとtrimethylselenonium ionとして尿中へ排泄されることが知られており5)、実際にこのような摂取条件下で尿を測定すると図のようになります6)(図)。この単純メチル化代謝物は、テルルを摂取した時にも尿中に見出されます。すなわち、必須元素とは言え、所要量を上回る曝露があった場合は、非必須元素と同じ経路で代謝されます。毒性学の父と言われるパラケルススの言に倣うと“ミネラルが必須であるか非必須であるかは、摂取量が決める”と代謝の観点から言えるのではないでしょうか。
引用文献:
- 1)
- 日本人の食事摂取基準(2020年版), 371.
https://www.mhlw.go.jp/content/10904750/000586553.pdf - 2)
- Rayman, M.P. (2000): The importance of selenium to human health. Lancet 356, 233-241.
doi: 10.1016/S0140-6736(00)02490-9 - 3)
- 小椋康光 (2009): 植物におけるセレン及びその同族元素の代謝機構. Biomed. Res. Trace Elements 20, 240-246.
doi: 10.11299/brte.20.240 - 4)
- Ogra, Y. and Anan, Y. (2009): Selenometabolomics: Identification of selenometabolites and specification of their biological significance by complementary use of elemental and molecular mass spectrometry. J. Anal. At. Spectrom. 24, 1477-1488.
doi: 10.1039/B910235C - 5)
- Kraus, R.J., Foster, S.J. and Ganther, H.E. (1985): Analysis of trimethylselenonium ion in urine by high-performance liquid chromatography. Anal. Biochem. 147, 432-436.
doi: 10.1016/0003-2697(85)90293-3 - 6)
- Ogra, Y. (2017): Biology and toxicology of tellurium explored by speciation analysis. Metallomics 9, 435-441.
doi: 10.1039/C7MT00022G
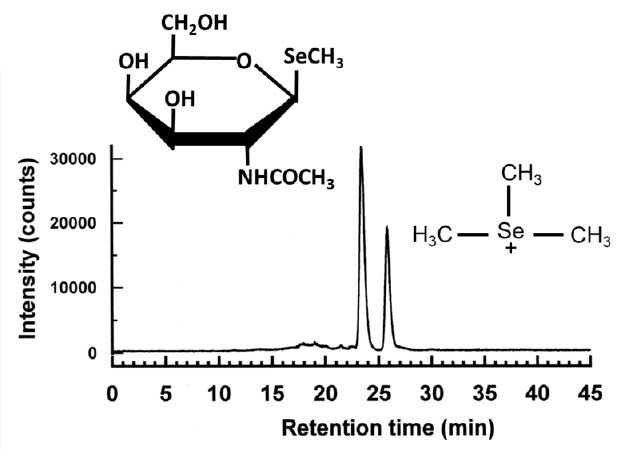
主に2つのセレン代謝物が観察され、早く溶出する代謝物がセレン糖で、遅い方がトリメチルセレノニウムイオンであることが同定されています。
2021年 千葉大学大学院薬学研究院
小椋 康光
エクスポソーム
西ヨーロッパの一卵性双子のコホート研究において慢性疾患の人口寄与率が算出された結果、ヒトの各種疾患には宿主因子より環境因子の影響が大きいという事実が明らかとなりました1)。ヒトは日々、生活環境、ライフスタイルや食生活を通じて様々な環境ストレスに晒されます。環境ストレスという言葉からは、大気、水および土壌中の汚染物質、産業化学物質、農薬や放射線等を連想しますが、医薬品、食品や嗜好品中の成分も含まれます。疾病はヒトがこのような莫大な環境因子に複合かつ慢性的に曝露されることで、健康な状態から未病を経て、病気へと進展することが示唆されています。
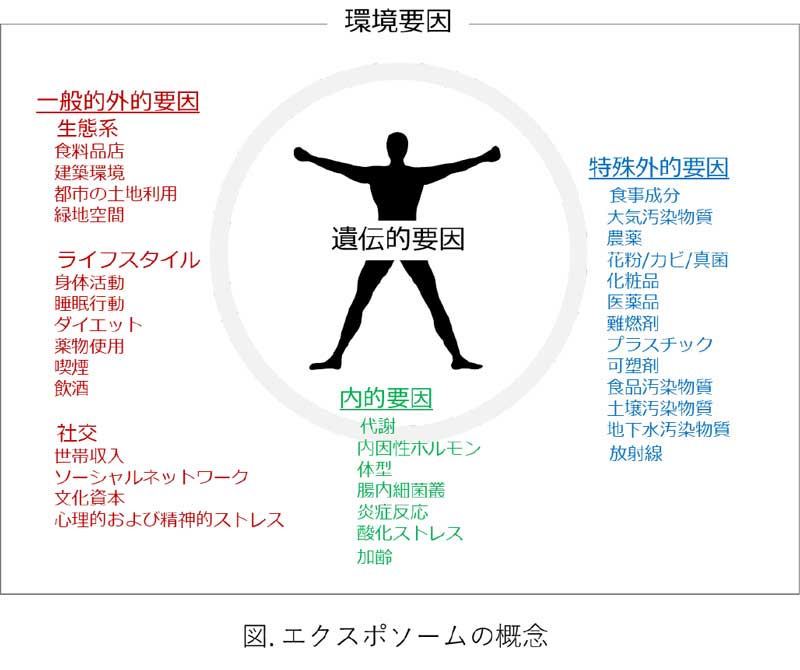
非遺伝的要因が疾病の発症に中心的な役割を果たすとの認識が深まり、国際がん研究機関の所長だったChristopher Wildは2005年に「エクスポソーム」という用語とその概念を提供しました2)。エクスポソーム(exposome)とはエクスポジャー(exposure)とオーム(ome)の混成語であり、出生前からのライフスタイル要因を含む生涯環境曝露を包括することを意味します。2012年にWildは、環境要因を一般的外的要因、内的要因および特殊外的要因に分類(図)しましたが3)、現在では物理的および化学的要因、生態系、ライフスタイルおよび社会的要因に分類するケースも見られます4)。エクスポソームは魅力ある概念である一方で遠大であり、研究対象としての捉えにくさが研究の進展を阻んできました。
しかし、エクスポソームの前に血液(Blood)、唾液(Saliva)、食物(Food)、大気汚染(Air pollution)、生態(Eco)、ヒト(Human)、内部(Internal)、外部(External)や化学物質(Chemical)等を付けた限定エクスポソーム研究による状況の打開が図られ、当該分野の研究は急速に進むとともに、2021年にはOxford Pressから「エクスポソーム」という学術雑誌も刊行されました。なお、エクスポソームに関する優れた総説が刊行されているのでご参照ください5,6)。
このような潮流の中、環境中に遍在する親電子物質の単独曝露に関する研究成果をもとに7,8)、非細胞、細胞および個体レベルにおいてその複合曝露(環境中親電子物質エクスポソーム)を実施した結果、タンパク質の化学修飾、細胞内レドックスシグナル系の変動、親電子物質の組織中蓄積、細胞毒性およびマウスの中毒症状等を指標にした場合、環境中親電子物質の単独曝露に比べて複合曝露はそれぞれの閾値を低くすることが示されています9-11)。
引用文献:
- 1)
- Rappaport, S.M. (2016): Genetic factors are not the major causes of chronic diseases. PLoS One, 11, e0154387.
doi: 10.1371/journal.pone.0154387 - 2)
- Wild, C.P. (2005): Complementing the genome with an "exposome": the outstanding challenge of environmental exposure measurement in molecular epidemiology. Cancer Epidemiol. Biomarkers Prev., 14, 1847-1850.
doi: 10.1158/1055-9965.EPI-05-0456 - 3)
- Wild, C.P. (2012): The exposome: from concept to utility. Int. J. Epidemiol., 41, 24-32.
doi: 10.1093/ije/dyr236 - 4)
- Vermeulen, R., Schymanski, E., Barabasi,A.L. and Miller, G.W. (2020): The exposome and health: Where chemistry meets biology. Science, 367, 392-396.
doi: 10.1126/science.aay3164 - 5)
- Miller, G.W. (2020): The Exposome 2nd Edition: A new paradigm for the Environment and Health (Miller, G. W., ed.,), pp. 1-275, Academic Press, San Diego. ISBN: 978-0128140796
- 6)
- Niedzwiecki M.M., Walker D.I., Vermeulen, R., Chadeau-Hyam, M., Jones, D.P. and Miller, G.W. (2019): The Exposome: Molecules to Populations. Annu. Rev. Pharmacol. Toxicol., 59, 107-127.
doi: 10.1146/annurev-pharmtox-010818-021315 - 7)
- Kumagai, Y. and Abiko, Y. (2017): Environmental electrophiles: protein adducts, modulation of redox signaling and interaction with persulfides/polysulfides. Chem. Res. Toxicol., 30, 203-219.
doi: 10.1021/acs.chemrestox.6b00326 - 8)
- 熊谷嘉人 (2020): エクスポソーム. 実験医学増刊号, 38 (10), 14-19. ISBN 978-4-7581-0387-9
- 9)
- Abiko, Y., Aoki, H. and Kumagai, Y. (2021): Effect of combined exposure to environmental aliphatic electrophiles from plants on Keap1/Nrf2 activation and cytotoxicity in HepG2 cells: a model of an electrophile exposome. Toxicol. Appl. Pharmacol., 413, 115392.
doi: 10.1016/j.taap.2020.115392 - 10)
- Abiko, Y., Kurosawa, K., Yamakawa, H. and Kumagai, Y. (2021): Activation of PTP1B/EGFR signaling and cytotoxicity during combined exposure to ambient electrophiles in A431 cells. J. Toxicol. Sci., 46, 177-185.
doi: 10.2131/jts.46.177 - 11)
- Akiyama, M., Shinkai, Y., Yamakawa, H. and Kumagai, Y. (2022): Potentiation of methylmercury toxicity by combined metal exposure: in vitro and in vivo models of a restricted metal exposome. Chemosphere, 299, 134374.
doi: 10.1016/j.chemosphere.2022.134374
2023年 筑波大学 医学医療系 環境生物学分野
熊谷 嘉人
毒性発現における腸内細菌叢の関与
腸内細菌は実に多種多様であり、これらはある一定のバランスが保たれた「腸内細菌叢」という生態系を構築しています。そして、腸内細菌叢は、D-アミノ酸、ビタミン、短鎖脂肪酸などの合成に関わることで、宿主の代謝や生理機能に多大な影響をもたらしています1)。
細菌叢の異常と様々な疾患病態の関連性が示唆されるようになってきました。さらに近年においては、細菌叢が腸管神経系を介して、脳と双方向的なネットワークを形成(脳腸相関)していることが報告されており、神経発達症や精神疾患の多くでは、細菌叢の多様性が低下(細菌種や細菌数の減少)した「Dysbiosis(腸内毒素症)」と呼ばれる状態にあることが指摘されています2)。
それでは、なぜDysbiosisが病態へつながる可能性があるのでしょうか。現在考えられている主なメカニズムとしては、菌叢バランスの変動が特定の生理活性物質レベルを増減させることが提唱されています3)。あるいは、腸管のバリア機能が低下するLeaky gut(腸管壁浸漏症候群)を発端に、有害な毒素や炎症誘発成分が血液中に流入し、全身へ広がるというメカニズムも提唱されています4)。一方で、病態に関わる菌種の特定が容易ではないこと、神経系・免疫系・内分泌系のシグナルと複雑に絡み合っていることから、未だ不明な点も多く存在しています。
古くから母子継承が知られるデーデルライン杆菌が有名ですが、興味深いことに、新生児の腸内細菌叢は母子伝播によって形成されることが分かっています5)。さらに、周産期の環境要因(分娩および授乳形態、化学物質によるばく露影響など)によって幼少期の菌叢バランスが変動し、将来的な疾患発症の要因となる可能性が指摘されています。成長後も、細菌叢の構成は、宿主を取り巻く環境(ライフステージ、食事、化学物質、ストレスなど)によって変動することが知られ、そのため、種々の疾患発症において腸内細菌叢はこれら環境要因の標的となる可能性があります。その一方で、病態に対する予防・改善のための介入対象としても注目されています。特に、プロバイオティクス(生きた有用菌の摂取)・プレバイオティクス(腸内の有用菌を増殖させる食品成分の摂取)やFMT(Fecal Microbiota Transplantation、糞便微生物移植)のような、腸内環境を正常化するアプローチの重要性が一層高まっていくと考えられます。
引用文献:
- 1)
- Jandhyala, S. M., Talukdar, R., Subramanyam, C., Vuyyuru, H., Sasikala, M. and Nageshwar Reddy, D. (2015): Role of the normal gut microbiota. World journal of gastroenterology, 21(29), 8787–8803.
doi: 10.3748/wjg.v21.i29.8787 - 2)
- Wang, Y. and Kasper, L. H. (2014): The role of microbiome in central nervous system disorders. Brain, behavior, and immunity, 38, 1–12.
doi: 10.1016/j.bbi.2013.12.015 - 3)
- Wu, S.J., Bekhit, A.E.A., Wu, Q.P., Chen, M.F., Liao, X.Y., Wang, J. and Ding, Y. (2021): Bioactive peptides and gut microbiota: Candidates for a novel strategy for reduction and control of neurodegenerative diseases. Trends in Food Science & Technology, 108, 164-176.
doi: 10.1016/j.tifs.2020.12.019 - 4)
- Luca, M., Chattipakorn, S. C., Sriwichaiin, S. and Luca, A. (2020): Cognitive-Behavioural Correlates of Dysbiosis: A Review. International journal of molecular sciences, 21(14), 4834.
doi: 10.3390/ijms21144834 - 5)
- Makino, H., Kushiro, A., Ishikawa, E., Kubota, H., Gawad, A., Sakai, T., Oishi, K., Martin, R., Ben-Amor, K., Knol, J. and Tanaka, R. (2013): Mother-to-infant transmission of intestinal bifidobacterial strains has an impact on the early development of vaginally delivered infant's microbiota. PloS one, 8(11), e78331.
doi: 10.1371/journal.pone.0078331
2022年 東北大学大学院農学研究科 動物生殖科学分野
佐々木 貴煕、種村 健太郎
医薬品の安全性の性差
性別差(以下、性差)の発生要因を探索する医学研究は、近年、熱い関心を集めています。性別は生来のもので人為的な変更は困難ですが、医薬品の安全性における性差は医薬品曝露の際の応答性の差に顕れるように、他の事象との相互作用で動的に生じるものであり、その発生機序が明らかとなれば調整が可能なものです。世の中の約半分が相互に異なる性であることを踏まえて整備が進めば、個別化医療の大きな推進力になると期待されます。
医薬品の安全性に関する調査では、重篤で致死的な薬物有害事象(ADR)、例えば抗がん薬や免疫調整薬での死亡などは男性の方が多く報告されています。一方、女性ではADRの報告数が全般的に多く、服薬を継続できないため中断に至り、結果として効果も不十分となるリスクが懸念されています1)。ただし男女では生理学的な性差もあり、病態自体が異なる場合もあるので、ADRの報告数の男女差を一概に説明することは難しく、疾患別・薬効分類別に検討が進むことも重要です。
性差を薬力学的性差と薬物動態学的性差に分類することは、メカニズムの整理やその後の対応策を考案するために有用です。例えば薬物動態学的性差に起因する男女別の用量設定のある医薬品の一つにラモセトロン塩酸塩があり、女性は男性の半分の用量で承認されています2)。当初、同用量では男性よりも女性の方でADRの発生頻度が高く、かつ女性では薬効の有意性が示されなかったため、本薬適応の対象から除外されていました3)。男性承認用量の5 μg単回投与では、薬物曝露の指標の一つである血中濃度-時間曲線下面積(AUC)が女性において男性の1.7倍高い結果であることが理由の一つとして考えられ、その後、女性に対して低用量の臨床試験が追加で実施されて、無事に有効性と安全性が認められて承認に至った経緯があります。ちなみにこのAUCの男女差は、女性では本薬の代謝酵素であるCYP1A2の活性が男性に比べて低く、体内からの消失が遅いためと考えられましたが、CYP1A2を阻害するフルボキサミンとの相互作用試験では男女ともにラモセトロン塩酸塩のAUCが上昇し、性による有意差はありませんでした2)。したがって薬物動態の性差の要因までは明らかではないものの、薬物動態がADRに関係している点が明瞭であれば、このケースのように用量調節が奏功するため、男女別の薬物動態情報が蓄積されることが望まれています。そのほか、薬力学的性差の事例では、ピオグリタゾン塩酸塩が知られており、女性では浮腫が起こりやすいため初回投与量は男性の半分に設定されています4)。このメカニズムは完全には解明されていませんが、性ホルモンによる感受性の違いの関与が示唆されています5)。
近年はファーマコビジランスの観点からADR報告のデータベース化が進み、様々な視点で包括的な性差の調査が報告されています1), 6-8) 。米国FDAの管理するFDA Adverse Event Reporting System(FAERS)に蓄積された男女別のADRの報告件数を単純に比較すると、片方の性に100倍~1000倍近く偏っている場合もあります。このように無視できない性の変動幅が推定されているADRの個別の対処は必要ですが、変動幅が大きい場合であってもADRの頻度が低い場合には情報の信頼性の課題もあります。性差を考慮した医療上の包括的なマネジメントのためには、性差が発生する論理的なメカニズムの追究・理解が重要です。
引用文献:
- 1)
- Sportiello, L. and Capuano, A. (2024): Sex and gender differences and pharmacovigilance: a knot still to be untied. Front. Pharmacol., 15, 1397291.
doi: 10.3389/fphar.2024.1397291 - 2)
- ラモセトロン塩酸塩(イリボーOD錠2.5μg/イリボーOD錠5μg)申請資料概要、審査報告書. 2015年5月26日.
- 3)
- ラモセトロン塩酸塩(イリボーOD錠2.5μg/イリボーOD錠5μg)インタビューフォーム2023年9月改訂(第18版)
- 4)
- ピオグリタゾン塩酸塩(アクトス錠15/30)添付文書2024年4月改訂(第2版)
- 5)
- Carruthers, M., Trinick, T.R., Jankowska, E. and Traish, A.M.(2008): Are the adverse effects of glitazones linked to induced testosterone deficiency? Cardiovasc Diabetol., 7, 30.
doi: 10.1186/1475-2840-7-30 - 6)
- Chandak, P. and Tatonetti, N.P. (2020): Using machine learning to identify adverse drug effects posing increased risk to women. Patterns, 1, 100108.
doi: 10.1016/j.patter.2020.100108 - 7)
- de Vries S.T., Denig, P., Ekhart, C., Burgers, J.S., Kleefstra, N., Mol, P.G.M. and van Puijenbroek, E.P. (2019): Sex differences in adverse drug reactions reported to the National Pharmacovigilance Centre in the Netherlands: An explorative observational study. Br J Clin Pharmacol., 85, 1507-1515.
doi: 10.1111/bcp.13923 - 8)
- Holm, L., Ekman, E. and Blomgren, K.J. (2017): Influence of age, sex and seriousness on reporting of adverse drug reactions in Sweden. Pharmacoepidemiol Drug Saf., 26, 335-343.
doi: 10.1002/pds.4155
2025年 千葉大学 大学院薬学研究院 臨床薬理学研究室
佐藤 洋美
抗体医薬品のFc領域が関わる免疫機能と毒性懸念
抗体はFc領域を介してFcγ受容体(FcγR)、補体成分(C1q)、胎児性Fc受容体 (FcRn)などに結合します。これらとの相互作用により抗体医薬品はFcγRを介したNK細胞やマクロファージの活性化による抗体依存性細胞傷害(ADCC)や抗体依存性細胞貪食(ADCP)、C1q結合を介した補体依存性細胞傷害(CDC)、FcRnを介したエンドソームから細胞外への抗体リサイクリングなどの機能を発揮します1), 2)。
抗体医薬品のFc領域改変技術は、医薬品の薬理作用を高めて感染症やがんに対する治療効果を最大化するために使われています3), 4)。例えばFcγRIIIaへの結合を高めた抗体はADCC活性を増強し5), 6)、C1qへの結合を高めた抗体はCDC活性を増強することができます7)。通常、可溶型抗原と抗体の複合体はピノサイトーシスにより偶発的に内皮細胞、単球、マクロファージなどに取り込まれ分解されますが、中性域のFcRn結合性あるいはFcγR結合性を高めるスイーピング技術を用いることで、積極的に血漿中の抗原-抗体複合体を細胞内に取り込み、病態の原因となる抗原を効率的に除去することができます1), 8), 9)。
一方でFc領域の改変に関わる安全性懸念もあります。活性型FcγRであるFcγRI、IIa、IIIaに対する結合増強を狙った抗体医薬品と活性型FcγRの結合や、抗原と抗体医薬品が形成する免疫複合体と活性型FcγRの結合は、炎症性メディエーターの放出やサイトカイン産生、貪食、血小板活性化などのエフェクター細胞機能を過剰にさせる懸念があります6), 10)-14)。FcγRには遺伝子多型があり、IgGに対する高親和性多型としてFcγRIIIa-V158やFcγRIIa-H131が知られていますが、このような高親和性FcγRと抗体医薬品の結合も過剰な免疫反応としてサイトカイン産生による炎症や正常組織へのダメージを引き起こす懸念があります6), 11), 13)。抑制型FcγRであるFcγRIIbはBリンパ球、マクロファージ、肥満細胞、および好塩基球に発現し、そのシグナル増強は免疫抑制を起こす可能性があります13), 15)。免疫機能の多様性に加え、各FcγRは異なるIgG親和性を持つことから13), 16)、創薬研究においては個々の抗体医薬品のFc領域改変が免疫機能に与える影響を適切に判断するために、FcγR結合能と免疫細胞活性化または抑制化に対する評価を行います。また、抗体はC1qを介して炎症、貪食に関与するため、抗体医薬品のC1q結合増強は補体依存性の炎症反応や免疫原性に影響する懸念があります17)。FcRn結合を増強した抗体医薬品に対しては、血中半減期延長や体内分布の変化に考慮が必要です2), 18)。
非臨床毒性評価で用いられるげっ歯類や非ヒト霊長類の免疫細胞とヒトの免疫細胞では、FcγRの種類、抗体との結合性、発現細胞および機能に種差があります18), 19)。また、マウスはFcRnのIgG結合に重要なアミノ酸残基がヒトと一部異なり、FcRn結合が関与する体内動態についてヒトへの外挿性が高くないことが想定されます18), 20)。このため抗体医薬品の安全性評価では種差を十分に考慮するとともに、ヒト免疫細胞、ヒトFcγR発現レポーター細胞、トランスジェニックマウスなどのツールを用いて総合的にヒト外挿性を解釈することが大切です18), 20), 21)。
引用文献:
- 1)
- Mimoto F., Kuramochi T., Katada H., et al. (2016): Fc Engineering to Improve the Function of Therapeutic Antibodies. Curr. Pharm. Biotechnol. 17, 1298-1314.
doi: 10.2174/1389201017666160824161854 - 2)
- Yip V., Palma E., Tesar D.B., et al. (2014): Quantitative cumulative biodistribution of antibodies in mice: effect of modulating binding affinity to the neonatal Fc receptor. mAbs, 6, 689-696.
doi: 10.4161/mabs.28254 - 3)
- Hale G., Davy A.D., and Wilkinson I. (2024): Systematic analysis of Fc mutations designed to enhance binding to Fc-gamma Receptors. mAbs, 16, 2406539.
doi: 10.1080/19420862.2024.2406539 - 4)
- Wang X., Mathieu M., and Brezski R.J. (2018): IgG Fc engineering to modulate antibody effector functions. Protein Cell, 9, 63-73.
doi: 10.1007/s13238-017-0473-8 - 5)
- Lazar G.A., Dang W., Karki S., et al. (2006): Engineered antibody Fc variants with enhanced effector function. Proc. Natl. Acad. Sci. USA, 103, 4005-4010.
doi: 10.1073/pnas.0508123103 - 6)
- Kircheis R., Halanek N., Koller I., et al. (2012): Correlation of ADCC activity with cytokine release induced by the stably expressed, glyco-engineered humanized Lewis Y-specific monoclonal antibody MB314. mAbs, 4, 532-541.
doi: 10.4161/mabs.20577 - 7)
- Moore G.L., Chen H., Karki S, et al. (2010): Engineered Fc variant antibodies with enhanced ability to recruit complement and mediate effector functions. mAbs, 2, 181-189.
doi: 10.4161/mabs.2.2.11158 - 8)
- 前田敦彦, 舟木美歩, 井川智之 (2015): 新規抗体改変技術とその抗体医薬品への応用. ファルマシア 51, 424-428.
doi: 10.14894/faruawpsj.51.5_424 - 9)
- Igawa T., Maeda A., Haraya K., et al. (2013): Engineered monoclonal antibody with novel antigen-sweeping activity in vivo. PLoS One, 8, e63236.
doi: 10.1371/journal.pone.0063236 - 10)
- Alakhras N.S., Qiu J., Rocha G.V., et al. (2018): FcγRIIIa-dependent IFN-γ release in whole blood assay is predictive of therapeutic IgG1 antibodies safety. mAbs, 10, 913-921.
doi: 10.1080/19420862.2018.1474996 - 11)
- Arman M. and Krauel K. (2015): Human platelet IgG Fc receptor FcγRIIA in immunity and thrombosis. J. Thromb. Haemost., 13, 893-908.
doi: 10.1111/jth.12905 - 12)
- Bugelski P.J., Achuthanandam R., Capocasale R.J., et al. (2009): Monoclonal antibody-induced cytokine-release syndrome. Expert Rev. Clin. Immunol., 5, 499-521.
doi: 10.1586/eci.09.31 - 13)
- Sibéril S., Dutertre C.A., Fridman W.H., et al. (2007): FcγR: The key to optimize therapeutic antibodies? Crit. Rev. Oncol. Hematol., 62, 26-33.
doi: 10.1016/j.critrevonc.2006.12.003 - 14)
- Tada M., Aoyama M., and Ishii-Watabe A. (2020): Fcγ Receptor Activation by Human Monoclonal Antibody Aggregates. J. Pharm. Sci., 109, 576-583.
doi: 10.1016/j.xphs.2019.10.046 - 15)
- Iwata Y., Katada H., Okuda M., et al. (2023): Preclinical in vitro evaluation of immune suppression induced by GYM329, Fc-engineered sweeping antibody. J. Toxicol. Sci.,48, 399-409.
doi: 10.2131/jts.48.399 - 16)
- 高井俊行 (2005): Fcγレセプターによる免疫制御と疾患. Jpn. J. Clin. Immunol., 28, 318-326.
doi: 10.2177/jsci.28.318 - 17)
- Lagassé H.A.D., Hengel H., Golding B., et al. (2019): Fc-Fusion Drugs Have FcγR/C1q Binding and Signaling Properties That May Affect Their Immunogenicity. AAPS J. 21, 62.
doi: 10.1208/s12248-019-0336-8 - 18)
- Ishii-Watabe A., Tada M., Suzuki T., et al. (2015): Nonclinical Evaluation of Next-generation Therapeutic Monoclonal Antibodies. Yakugaku Zasshi, 135, 7, 857-866.
doi: 10.1248/yakushi.15-00007-3 - 19)
- Warncke M., Calzascia T., Coulot M., et al. (2012): Different Adaptations of IgG Effector Function in Human and Nonhuman Primates and Implications for Therapeutic Antibody Treatment. J. Immunol. 188, 4405-4411.
doi: 10.4049/jimmunol.1200090 - 20)
- Ishii-Watabe A., Suzuki T., Tada M., et al. (2010): FcRn, a critical regulator of antibody pharmacokinetics. Nihon Yakurigaku Zasshi, 136, 280-284.
doi: 10.1254/fpj.136.280 - 21)
- Tada M., and Ishii-Watabe A., (2017): Characterization of Therapeutic Monoclonal Antibodies by Using FcγR-expressing Reporter Cell Lines. Yakugaku Zasshi, 137, 837-843.
doi: 10.1248/yakushi.16-00252-4
2025年 中外製薬株式会社 トランスレーショナルリサーチ本部 安全性バイオサイエンス研究部
原田 麻子
動態・代謝
マイクロサンプリングのGLP試験における活用
医薬品等の非臨床安全性試験において、曝露評価は毒性評価との関連性検討のために重要です。このためICH S3A「トキシコキネティクス(毒性試験における全身的暴露の評価)に関するガイダンス」1)が発出されています。一方、これまで薬物濃度評価のためには1時点当たり多くの血液量が必要であったため、主試験群の他にサテライト群という別の動物群設定が必要でした。しかし近年、薬物濃度測定系の高感度化により、50µL以下の血液量で評価が可能となってきました。このような微量サンプリング(マイクロサンプリング)の利用に関するICH S3AガイドラインのQ&Aが2017年に最終化され、本邦でも2019年3月に発出されています2)。
マイクロサンプリングは本邦より欧州の方が取り組みの歴史が長く、既にGLP試験でマイクロサンプリング手法が採用されたケースも報告されています。欧米を中心とする39社を対象にした2017年の調査では、半数以上の企業が治験申請時にGLP試験についてげっ歯類のマイクロサンプリングデータを使用し、約1/4の企業が製造販売承認申請時にマイクロサンプリングを利用したげっ歯類及び非げっ歯類のGLP試験データを含めたとの報告があります3)。
マイクロサンプリング部位として、欧米では尾静脈が良く用いられますが、本邦では鎖骨下静脈が汎用されています。ラットを対象とした28日間反復投与毒性試験を想定し、1日目と27日目に24時間で各6-7時点において各50 µLを鎖骨下静脈よりマイクロサンプリング法で採血した時、採血した動物に認められる所見は軽微で各評価項目における背景値の範囲内であり、それらを勘案した上で毒性評価に用いることは可能と報告されました4)。また、毒性が認められる被験物質3種(血液毒性:フェナセチン5)、メチレンブルー6)、免疫毒性:アザチオプリン6))に関し、ラットにおける毒性評価へのマイクロサンプリングの影響について検討が行われ、毒性プロファイルに大きな影響はないと考えられる結果が報告されています。本邦において、医薬品開発時のGLP試験におけるマイクロサンプリングの利用はまだ少ないものの、導入のための検討結果の報告数は増加しており、エビデンスは蓄積されつつあります。マイクロサンプリングは、主試験群動物でなされた場合に毒性評価値と薬物濃度との1:1での関連性解析が可能であること、また動物の苦痛軽減及び使用数の減少の点から動物福祉に貢献するため、その積極的な利用が期待されています。
引用文献:
- 1)
- トキシコキネティクス(毒性試験における全身的暴露の評価)に関するガイダンスについて.厚生省薬務局審査課長通知(平成8年7月2日 薬審第443号)
- 2)
- 「トキシコキネティクス(毒性試験における全身的暴露の評価)に関するガイダンス」 におけるマイクロサンプリング手法の利用に関する質疑応答集(Q&A)について.厚生労働省医薬生活衛生局医薬品審査管理課(平成31年3月15日 事務連絡)
- 3)
- Patel, S.R., Bryan, P., Spooner, N., Timmerman, P. and Wickremsinhe, E. (2019): Microsampling for quantitative bioanalysis, an industry update: output from an AAPS/EBF survey. Bioanalysis., 11, 619-628.
doi: 10.4155/bio-2019-0019 - 4)
- Yokoyama, H., Hattori, N., Ohtsuka, H., Murata, E., Kobayashi, A., Muta, K., Takumi, A., Kitaura, H., Jinno, F., Iwai, A., Nakai, K., Mori, K., Saito, K. and Saito, Y. (2020): Lack of toxicological influences by microsampling (50 µL) from jugular vein of rats in a collaborative 28-day study. J. Toxicol. Sci. 45, 319-325.
doi: 10.2131/jts.45.319 - 5)
- Ohtsuka, H., Takahashi, K., Kitaura, H., Kandori, H., Danbayashi, K., Higuchi, T., Jinno, F., Nitta, S.I., Mori, K., Iwai, A., Nakai, K., Saito, K. and Saito, Y. (2022): No obvious toxicological influences of 50 μL microsampling from rats administered phenacetin as a drug with hematological toxicity. J. Toxicol. Sci., 47, 193-199.
doi: 10.2131/jts.47.193 - 6)
- Tochitani, T., Sasaki, Y., Nishimura, N., Fujii, Y., Iwaisako, T., Umeya, N., Hashimoto, M., Inada, H., Chihara, K. and Miyawaki, I. (2022): Effects of microsampling on toxicity assessment of hematotoxic compounds in a general toxicity study in rats. J. Toxicol. Sci., 47, 269-276.
doi: 10.2131/jts.47.269
2022年
国際医療福祉大学 薬学部 小林章男
国立医薬品食品衛生研究所 医薬安全科学部 斎藤嘉朗
薬物代謝酵素による代謝的活性化と進化するその評価系
薬物代謝酵素が触媒する反応は、酸化・還元・加水分解の第I相反応と、抱合反応の第II相反応に分類されます。大村、佐藤によって1964年に同定されたシトクロムP450(P450)は酸化反応を触媒する代表的な薬物代謝酵素であり1) 、医薬品の代謝においては全体の75%に寄与すると言われています2)。次に医薬品代謝への寄与が大きい薬物代謝酵素は、グルクロン酸抱合反応を触媒するUDP-グルクロン酸転移酵素(UGT)であり、その寄与率は15%程度となっています2)。
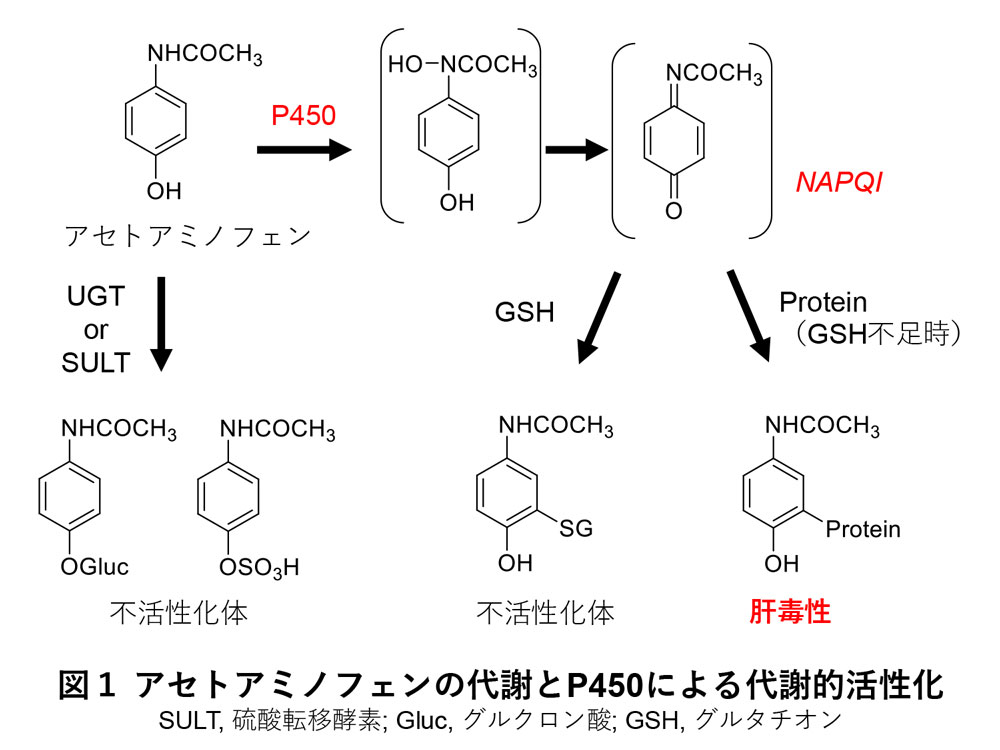
薬物代謝酵素の働きにより、薬毒物の大部分は薬効もしくは毒性を失った代謝物に変換され、体外へ排出されます。しかし、薬毒物の中には、より反応性が高い代謝物へと変換され、強い毒性や生物活性を示すものもあります。この現象は薬物代謝酵素による代謝的活性化もしくは代謝活性化と呼ばれます。代謝的活性化は、酸化反応、特にP450によるものが大部分であり、一例としてアセトアミノフェンの代謝的活性化が挙げられます3)。解熱鎮痛剤として広く用いられているアセトアミノフェンは、通常、グルクロン酸抱合や硫酸抱合を受け、体外へと排出されます。しかし、大量に摂取するとこれらの抱合反応が追いつかなくなり、P450により酸化されることで、反応性が高い代謝物NAPQI(N-acetyl-p-benzoquinonimine)へと変換されます。NAPQIはグルタチオン抱合を受けることで無毒化されますが、グルタチオンが不足した場合は、タンパク質などの生体高分子に結合し、重篤な肝障害を引き起こします(図1)4-6)。一方、第II相反応による代謝的活性化の例は少ないですが、UGTによるモルヒネの6位抱合体への変換や非ステロイド性抗炎症薬などのアシルグルクロニドの生成は、臨床的および毒性学的にも重要な知見です7-9)。
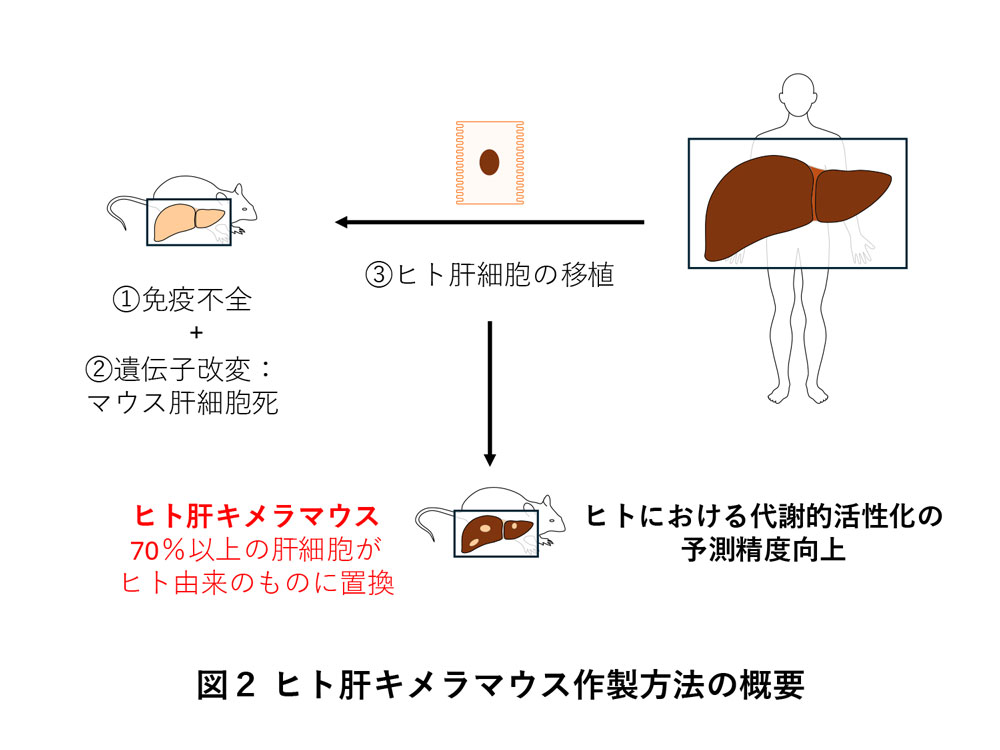
このような薬物代謝酵素による代謝的活性化の予測・評価は、医薬品や工業化学物質などの安全な使用に欠かせません。しかし、ヒトと実験動物との間には、薬物代謝酵素の種類、量、そして機能に大きな違いがあるため、動物実験だけでは正確な予測は困難です。とはいえ、ヒトにおける代謝的活性化の予測研究に必要な肝細胞や肝ミクロソームといったヒト肝臓由来の試料には限りがあるため、種差に関する問題を解決する手法の開発が課題となってきました。その解決方法の一つとして広く用いられているのが、ヒト肝キメラマウスです。ヒト肝キメラマウスは、免疫不全かつマウス肝細胞死を惹起する遺伝子改変が行われたレシピエントマウスに、ヒトの肝細胞を移植することで作製します(図2)10)。2001年に発表された当時はヒト肝細胞への置換率が15%未満だったものの11)、多くの改良が加えられた結果、肝臓の大部分(70%以上)をヒトの肝細胞で置換することに成功しており、現在ではヒトの薬物代謝酵素による代謝的活性化を予測・評価する上で強力なツールとなっています12-15)。マウスの改良は更に進んでおり、最近の報告では、P450の酵素活性に不可欠なP450還元酵素を、マウスの肝臓特異的にノックアウトすることで、残存するマウス肝細胞の影響を大きく低下させることに成功しています16)。今後もこのような研究ツールの開発・改良により、ヒトにおける代謝的活性化予測の更なる向上が期待されます。
引用文献:
- 1)
- Omura, T. and Sato, R. (1964): The carbon monoxide-binding pigment of liver microsomes. I. Evidence for its hemoprotein nature. J. Biol. Chem., 239, 2370-2378.
doi: 10.1016/S0021-9258(20)82244-3 - 2)
- Williams, J.A., Hyland, R., Jones, B.C., Smith, D.A., Hurst, S., Goosen, T.C., Peterkin, V., Koup, J.R. and Ball, S.E. (2004): Drug-drug interactions for UDP-glucuronosyltransferase substrates: a pharmacokinetic explanation for typically observed low exposure (AUCi/AUC) ratios. Drug Metab. Dispos., 32, 1201-1208.
doi: 10.1124/dmd.104.000794 - 3)
- Rendic, S.P. and Guengerich, F.P. (2024): Formation of potentially toxic metabolites of drugs in reactions catalyzed by human drug-metabolizing enzymes. Arch. Toxicol., 98, 1581-1628.
doi: 10.1007/s00204-024-03710-9 - 4)
- Lee, W.M. (2020): Acetaminophen toxicity: a history of serendipity and unintended consequences. Clin. Liver Dis., 16, 34-44.
doi: 10.1002/cld.984 - 5)
- Mitchell, J.R., Jollow, D.J., Potter, W.Z., Gillette, J.R. and Brodie, B.B. (1973): Acetaminophen-induced hepatic necrosis. IV. Protective role of glutathione. J. Pharmacol. Exp. Ther., 187, 211-217.
doi: 10.1016/S0022-3565(25)29666-5 - 6)
- Potter, W.Z., Davis, D.C., Mitchell, J.R., Jollow, D.J., Gillette, J.R. and Brodie, B.B. (1973): Acetaminophen-induced hepatic necrosis. III. Cytochrome P-450-mediated covalent binding in vitro. J. Pharmacol. Exp. Ther., 187, 203-210.
doi: 10.1016/S0022-3565(25)29665-3 - 7)
- Shimomura, K., Kamata, O., Ueki, S., Ida, S., Oguri, K., Yoshimura, H. and Tsukamoto, H. (1971): Analgesic effect of morphine glucuronides. Tohoku J. Exp. Med., 105, 45-52.
doi: 10.1620/tjem.105.45 - 8)
- Miyashita, T., Kimura, K., Fukami, T., Nakajima, M. and Yokoi, T. (2014): Evaluation and mechanistic analysis of the cytotoxicity of the acyl glucuronide of nonsteroidal anti-inflammatory drugs. Drug Metab. Dispos., 42, 1-8.
doi: 10.1124/dmd.113.054478 - 9)
- Van Vleet, T.R., Liu, H., Lee, A. and Blomme, E.A.G. (2017): Acyl glucuronide metabolites: Implications for drug safety assessment. Toxicol. Lett., 272, 1-7.
doi: 10.1016/j.toxlet.2017.03.003 - 10)
- 株式会社トランスジェニックグループHP,研究開発コラム
https://transgenic-group.co.jp/column/list_2.php - 11)
- Dandri, M., Burda, M.R., Török, E., Pollok, J.M., Iwanska, A., Sommer, G., Rogiers, X., Rogler, C.E., Gupta, S., Will, H., Greten, H. and Petersen, J. (2001): Repopulation of mouse liver with human hepatocytes and in vivo infection with hepatitis B virus. Hepatology, 33, 981-988.
doi: 10.1053/jhep.2001.23314 - 12)
- Tateno, C., Yoshizane, Y., Saito, N., Kataoka, M., Utoh, R., Yamasaki, C., Tachibana, A., Soeno, Y., Asahina, K., Hino, H., Asahara, T., Yokoi, T., Furukawa, T. and Yoshizato, K. (2004): Near Completely Humanized Liver in Mice Shows Human-Type Metabolic Responses to Drugs. Am. J. Pathol., 165, 901-912.
doi: 10.1016/S0002-9440(10)63352-4 - 13)
- Hasegawa, M., Kawai, K., Mitsui, T., Taniguchi, K., Monnai, M., Wakui, M., Ito, M., Suematsu, M., Peltz, G., Nakamura, M. and Suemizu, H. (2011): The reconstituted ‘humanized liver’ in TK-NOG mice is mature and functional. Biochem. Biophys. Res. Commun., 405, 405-410.
doi: 10.1016/j.bbrc.2011.01.042 - 14)
- Suemizu, H., Hasegawa, M., Kawai, K., Taniguchi, K., Monnai, M., Wakui, M., Suematsu, M., Ito, M., Peltz, G. and Nakamura, M. (2008): Establishment of a humanized model of liver using NOD/Shi-scid IL2Rgnull mice. Biochem. Biophys. Res. Commun., 377, 248-252.
doi: 10.1016/j.bbrc.2008.09.124 - 15)
- Masumoto, N., Tateno, C., Tachibana, A., Utoh, R., Morikawa, Y., Shimada, T., Momisako, H., Itamoto, T., Asahara, T. and Yoshizato, K. (2007): GH enhances proliferation of human hepatocytes grafted into immunodeficient mice with damaged liver. J. Endocrinol., 194, 529-537.
doi: 10.1677/joe-07-0126 - 16)
- Uehara, S., Iida, Y., Ida-Tanaka, M., Goto, M., Kawai, K., Yamamoto, M., Higuchi, Y., Ito, S., Takahashi, R., Kamimura, H., Ito, M., Yamazaki, H., Oshimura, M., Kazuki, Y. and Suemizu, H. (2022): Humanized liver TK-NOG mice with functional deletion of hepatic murine cytochrome P450s as a model for studying human drug metabolism. Sci. Rep., 12, 14907.
doi: 10.1038/s41598-022-19242-0
2025年 崇城大学 薬学部
宮内 優
化学物質の有害作用,安全性評価・管理
薬物アレルギー
薬物による有害反応は、薬物自体の薬理作用によって説明可能な副作用としての「中毒性」と、それでは説明できない5,000~10,000人に一人或いはそれ以下に稀におこる毒性、即ち、患者の体質に起因すると考えられる「特異体質性毒性(idiosyncratic toxicity)」に分類されます。この「特異体質性」の中に、免疫学的機序に基づいた「薬物アレルギー」が存在します。薬物アレルギーは、他のアレルギー疾患と同様に、大きく即時型と遅延型に分けられ、更にCoombsとGellの分類に基づき、Ⅰ型からⅣ型に分けられます。Ⅰ型~Ⅲ型は血清抗体が関与した体液性免疫による即時型、Ⅳ型は感作リンパ球による細胞性免疫による遅延型のアレルギー反応です。
薬物アレルギーの症状としては、アナフィラキシー(Ⅰ型)、溶血性貧血などの血液障害(Ⅱ・Ⅲ型)や、スティーブンスジョンソン症候群(SJS)/中毒性表皮壊死症(TEN)に代表される皮膚粘膜障害(Ⅳ型)が挙げられます。アナフィラキシーは、原因薬物がIgEに結合してそれを架橋することによって好塩基球や肥満細胞からヒスタミンやロイコトリエンが脱顆粒することで起こり、その原因薬物として抗がん剤、造影剤、血液製剤や抗菌薬が知られています。溶血性貧血を起こす薬物としてはペニシリン系抗菌薬が著名で、薬物が赤血球膜上のタンパク質に結合し免疫原性のあるハプテンを形成することで発症すると考えられています。その他に、赤血球に対する自己抗体(IgGやIgM)の形成を誘導することで赤血球に傷害をもたらす薬物(αメチルドパ、レボフロキサシンなど)や、薬物が抗原となりそれに対する抗体との複合体形成を介して赤血球の破壊を起こす薬物(テイコプラニンやオメプラゾールなど)も、溶血性貧血を起こす可能性があります。
近年のゲノムワイド関連解析から、遅延型のアレルギーであるSJS/TENなどのアレルギー反応には、ヒト白血球抗原(HLA)の特定の多型が関与する報告が相次いでいます1)。例えば、カルバマゼピンはHLA-B*15:02遺伝子、アロプリノールはHLA-B*58:01遺伝子と強く関連することが知られています。それらの発症機序として、薬物がHLA上のペプチドと結合してハプテンを形成することや、薬物がHLAと直接結合することなどが可能性として考えられています2)。これらの毒性は生命を脅かす危険性もあることから予測バイオマーカーの探索が進められており、最近ではHLA遺伝子を導入したマウスを用いたメカニズム探求も行われています3)。そこから、原因となるHLA遺伝子のみならず、免疫の暴走を抑える機構の個人差などの患者の状態も発症を決める重要な要因となることが見出されています。
引用文献:
- 1)
- Usui, T. and Naisbitt, D.J. (2017): Human leukocyte antigen and idiosyncratic adverse drug reactions. Drug Metab Pharmacokinet, 32, 21-30.
doi: 10.1016/j.dmpk.2016.11.003 - 2)
- Sullivan, A., Watkinson, J., Waddington, J., Park, B.K. and Naisbitt, D.J. (2018): Implications of HLA-allele associations for the study of type IV drug hypersensitivity reactions. Expert Opin Drug Metab Toxicol, 14, 261-274.
doi: 10.1080/17425255.2018.1441285 - 3)
- Susukida, T., Kuwahara, S., Song, B., Kazaoka, A., Aoki, S. and Ito, K. (2021): Regulation of the immune tolerance system determines the susceptibility to HLA-mediated abacavir-induced skin toxicity. Commun Biol, 4, 1137.
doi: 10.1038/s42003-021-02657-2
2022年 千葉大学大学院 薬学研究院 生物薬剤学研究室
青木 重樹
サプリメントの安全性評価と課題
健康食品と称する多種多様な食品の中で、特定成分が濃縮・強化されたサプリメントの利用が増えています。サプリメントとは、健康の維持・増進に特別に役立つことをうたって販売されている錠剤・カプセルなどの形状で、医薬品以外の経口摂取されるものを指します。我が国では国民の3~4割がサプリメントを利用しており、特に高齢者に多いことが報告されています1)。ちなみに米国では7割程度が毎日何らかのサプリメントを利用しているようです2)。
安全性の観点から、サプリメントは通常の食品とは異なる認識を持つ必要があります。通常の食品形態であれば、体積、味や香りと私たちの嗜好性から、特定成分を継続的かつ過剰量で摂取することはありません。一方、サプリメントは特定成分を効率的に摂取できる利点はありますが、摂取量と生体影響の関係が認識されない状況で、継続的に過剰摂取されうるという欠点があるのです。また、サプリメントの品質管理はあくまで食品のレベルで、製品は消費者の自己判断で利用されています。病者が医療関係者に伝えずにサプリメントと医薬品を併用している実態があり3)、医薬品との相互作用が潜在的に起きている可能性もあります。
食品の安全性評価において食経験の有無は重要です。その要素として食品として伝統的に摂取されてきた期間、調製法、摂取法、摂取レベルがあります4)。サプリメントはそれらの要素を満たしていません。また、一般にサプリメントは医薬品のように単一の成分では構成されていません。多くの消費者が天然・自然が安全とイメージしていることから5)、多くのサプリメントの原材料にハーブ類などの天然物が利用されています。天然物は一つの原材料でも含有成分の管理が難しく、そのような原材料がサプリメントには複数含まれていることがあります6)。米国ではハーブサプリメントによる肝機能障害が増えているという報告があります7)。
食経験のない原材料については、安全性試験を実施する必要があります。しかし、原材料の品質が定かでなければ、特定の原材料の安全性試験が実施されていても、その結果は他の原材料やそれを含む製品に適用できるとは言えません。原材料や製品の品質が確保できていなければ、有害事象が起きた際の原因究明は難しく、医薬品との相互作用の検討も困難です。また、一つの原材料に関する信頼できる臨床試験(ランダム化比較試験等)が実施されていたとしても、その有効性情報は複数の原材料から構成される製品に安易に適用することもできません。
以上のようにサプリメントの安全性を検討するための前提条件として、製品に含まれている個々の原材料の規格化と製品の品質管理が必要です。原材料中の活性成分等について規格ができていれば、同じ原材料を利用した製品による健康被害情報を収集・分析することで、ヒトにおける安全な摂取量を推定することができます8)。
引用文献:
- 1)
- 令和元年国民健康・栄養調査結果の概要
- 2)
- Ronis, M.J.J., Pedersen, K.B. and Watt, J.(2018): Adverse Effects of Nutraceuticals and Dietary Supplements. Annu. Rev. Pharmacol. Toxicol., 58, 583-601.
doi: 10.1146/annurev-pharmtox-010617-052844 - 3)
- Chiba, T., Sato, Y., Nakanishi, T., Yokotani, K., Suzuki, S. and Umegaki, K. (2014): Inappropriate usage of dietary supplements in patients by miscommunication with physicians in Japan. Nutrients, 6, 5392-404.
doi: 10.3390/nu6125392 - 4)
- Constable, A., Jonas, D., Cockburn, A., Davi, A., Edwards, G., Hepburn, P., Herouet-Guicheney, C., Knowles, M., Moseley, B., Oberdorfer, R. and Samuels, F. (2007): History of safe use as applied to the safety assessment of novel foods and foods derived from genetically modified organisms. Food Chem. Toxicol. 45, 2513-25.
doi: 10.1016/j.fct.2007.05.028 - 5)
- Gaston, T.E., Mendrick, D.L., Paine, M.F., Roe, A.L. and Yeung, C.K. (2020): "Natural" is not synonymous with "Safe": Toxicity of natural products alone and in combination with pharmaceutical agents. Regul. Toxicol. Pharmacol.113, 104642.
doi: 10.1016/j.yrtph.2020.104642 - 6)
- 梅垣敬三, 中村洸友, 山田浩 (2023): 医療関係者から提供された健康食品の有害事象の特徴およびその因果関係評価アルゴリズムへの適用. 食衛誌, 64, 13-20.
doi: 10.3358/shokueishi.64.13 - 7)
- Navarro, V.J., Khan, I., Bjornsson, E., Seeff, L.B., Serrano, J. and Hoofnagle, J.H. (2017): Liver injury from herbal and dietary supplements. Hepatology, 65, 363-373.
doi: 10.1002/hep.28813 - 8)
- Nishijima, C., Chiba, T., Sato, Y. and Umegaki, K. (2019): Nationwide Online Survey Enables the Reevaluation of the Safety of Coleus forskohlii Extract Intake Based on the Adverse Event Frequencies. 11, 866.
doi: 10.3390/nu11040866
2023年 静岡県立大学
梅垣 敬三
メラミン
2,4,6-トリアミノ-1,3,5-トリアジンである。無色ないし白色の固体。
メラミン樹脂製造の原料。メラミン樹脂製品は、引っ張り強度、硬度、耐衝撃性が尿素樹脂より強いとされている。電気絶縁性や機械強度も大きい。
2007年、メラミン混入中国産ペットフードにより多数の犬や猫が腎不全等で死亡する事件があった。今回メラミン含有粉ミルクによる乳幼児の腎臓結石などの被害が発生し、死亡例の報告もある。メラミン自身の急性毒性は、強くはないが、実験動物への4500ppm食で、膀胱に移行型細胞癌腫の発生が米国NTPより報告されている。犬や猫の死亡例では、メラミンとそのアミノ基が水酸基になっているシアヌール酸との反応で結晶が生成し、腎結石となると考えられている。従って、メラミンとされている成分中に、不純物として他の含窒素化合物も含まれていた可能性もある。
食品中のタンパク含量の測定にケルダール法(セミミクロケルダールまたはミクロケルダール法)を用いるとしたら、本法では窒素含有量として定量し、タンパク質量を計算することから、化学構造からも明らかなように窒素含量の高いメラミンを混入すると、高タンパク食として算定されることになる(タンパク質は、分子中にほぼ窒素を16%含有)。
2008年 昭和大学薬学部毒物学教室
吉田 武美
NTP(National Toxicology Program):国家毒性プログラム。米国の連邦法に基づき、国立環境衛生科学研究所(NIEHS)等の各省庁機関が評価対象化学物質の選択、発がん性試験の実施及び分類を行っている。
有機スズ化合物
有機スズとは4価のスズ原子にアルキル基やアリール基が1-4個共有結合した有機金属化合物の総称である。 4置換体は他の有機スズ化合物生産の中間体として主に使用されている。3置換体は殺生物作用を有しており、殺菌剤、防黴剤、ダニ駆虫剤、ネズミ駆散剤、軟体動物駆除剤等として、農薬や木材の防腐のために使われてきた。 2置換体は商業上で最も重要であり、使用量は全有機スズ化合物の70%以上と推定されており、主にプラスティック工業の分野でポリマーの劣化防止のために塩化ビニル樹脂の熱、光安定剤として使われている。1置換体は塩化ビニル樹脂の安定剤として使用されている。
トリブチルスズ(TBT)とトリフェニルスズ(TPT)は1960年代から船底塗料や魚網への水生生物の付着を防止するための防汚剤製品中に広く使われてきた。1970年代の終わりから1980年代の初めにかけてヨーロッパのカキやムール貝の養殖事業に多大な損害を与えたことから、使用規制が行われるようになった。我が国では1990年に化審法により、ビス(トリブチルスズ)=オキシド(TBTO)が第1種特定化学物質に指定され、製造及び輸入が原則として禁止され、 TBTOを除くTBT化合物13物質及びTPT化合物7物質が同法に基づく第2種特定化学物質に指定され、製造及び輸入には事前の届出が必要となっている。2001年には国際海事機関(IMO)の外交会議において、2008年以降に船舶に塗布することを禁止するためのAFS条約が採択され、2003年以降TBT船底用塗料の新たな塗布を禁止し、2008年以降はすでに塗布されているTBT塗料を船体から除去するか海水に溶出しないように塗膜を塗布することとなった。河川、海、土壌、水底の泥中に存在する有機スズは微生物や紫外線により徐々にアルキル其やアリール其がはずれて無機化される。
TBT及びTPTは内分泌撹乱作用が疑われる物質とされており、巻貝にインポセックスによる繁殖障害を引き起こす。TBTは1 ppt程度で巻貝のイボニシにインポセックスを誘導する。ヒトでは、TPTの吸入事故による目眩、吐き気、一過性の意識消失、衰弱及び光恐怖症、経口摂取中毒例が報告されている。またジブチルスズオキシドの作業環境における皮膚障害がみられている。動物実験では、一般的には高分子量側鎖を有する有機スズ化合物の腸管吸収は低く、体内に吸収された有機スズはかなり早く脱アルキル化されて排泄されることが知られている。トリアルキルスズについては神経症状が特徴的であり、トルエチルスズ及びトリメチルスズで顕著に発現、四肢/後肢麻痺、振戦、過剰興奮、攻撃性等の症状を呈する。TBT、TPT、トリシクロヘキシルスズ、ジブチルスズ、ジオクチルスズ等が胸腺を萎縮させ、T細胞依存性の免疫機能を抑制等の免疫毒性を示すことが知られている。
FAO/WHO合同残留農薬専門家会議によるTPTの許容1日摂取量は0-0.5 µg/kg、WHOによるTBTOの経口曝露指針値は0.3 µg/kg、厚生労働省によるTBTOの暫定的許容1日摂取量は1.6 µg/kg、米国産業衛生専門家会議(ACGIH)は1日8時間、週40時間の繰り返し労働における作業者の許容限界値をスズとして0.1 mg/m3としている.
2011年 独立行政法人 産業技術総合研究所 安全科学研究部門
江馬 眞
メタミドホス
平成20年1月30日、輸入食品餃子を食して健康障害を起こした患者が発生し、その類似餃子から有機リン系殺虫剤メタミドホスが検出されたとの報道がなされた。その後相次いで餃子類からメタミドホス、ジクロロボス(DDVP)、パラチオン、メチルパラチオンと有機リン系殺虫剤検出が相次いだ。メタミドホスは、分子量は141.12の灰色がかった白色固体で、刺激臭のある水溶性物質である。強力なアセチルコリンエステラーゼ阻害作用を有し、浸透性で、残留性のある殺虫剤として海外で使用されてきている。毒性が強いこともあり、海外では死亡例の報告も多い。日本では農薬として流通することはなく、毒物・劇物取締法の対象外である。毒性面から使用禁止する国もある。米国では、商品に“Danger-Poison”の表示が義務づけられている。
哺乳類に対して経口、経皮、吸入各経路の暴露で強い毒性が発現する。例えば、経口LD50は、ラット21 mg/kg(雄)、16 mg/kg(雌)、経皮で50 mg/kg(ラット)、吸入で9 mg/kg(ラット)、19 mg/kg(マウス)などの値が報告されている。中毒症状は、有機リン系殺虫剤の特有の症状が発症し、かつヒトにおいて遅延性の神経障害も認められている。生殖毒性も0.15mg/kg/日から認められている。ヒトでも精子数の減少や精子の生存率の減少が報告されている。弱いながら変異原性があるが、発がん性はマウスとラットいずれにおいても確認されていない。NOEL(無毒性量)は、ラット56日間摂食試験で、0.03 mg/kg/日とされているが、犬に32 ppmまでの数段階用量での1年間試験では、体重、臓器重量、摂食量、血液や尿の生化学検査ではなんら有害作用は認められなかったとする報告もある。環境生物に対しては、鳥類に対する毒性は強く、魚毒性もある。
現在日本で使用されているアセフェートの脱アセチル化による微量代謝物でもある。
2008年 昭和大学薬学部毒物学教室
吉田 武美
LD50.:lethal dose 50 (50%致死量). ある一定の条件下で動物に試験物質を投与した場合に、動物の半数を死亡させる試験物質の量。
メチル水銀の中枢毒性
メチル水銀は水俣病の原因物質であり、高濃度含む工業廃水で汚染された海域に生息する魚介類の摂取により発症しました。メチル水銀の急性毒性症状として痺れ、視覚・聴覚異常など、慢性毒性症状として運動失調、歩行困難など、いずれも中枢神経の障害がもっぱら生じます。現在では厳しい法律や世界的な条約が定められ、水俣病のような高濃度メチル水銀曝露による健康被害は今後発生する可能性は低いと考えられています。現在、国民が摂取している水銀は、主に海水中の無機水銀が微生物によりメチル化され、大型魚類に生物濃縮により蓄積されたメチル水銀に由来しています。胎児の神経発達にとってはメチル水銀は比較的低濃度でもリスク因子となるため、2003年から妊娠中の魚介類摂取量について注意喚起がなされています1)。環境中の水銀の量は、1850年頃からの工業化によって2000頃まで直線的に増加しています(図)。近年、減少傾向に転じたという報告があります(※)。
さて、親電子性をもつメチル水銀は、求核性アミノ酸のシステイン (Cys) と非酵素的に共有結合し、中性アミノ酸であるメチオニンと類似した化学構造物となることが知られており、小腸においては中性アミノ酸トランスポーター(B(0)AT1)を介して吸収されます。毒性物質への感受性が高い脳は血液脳関門により保護されていますが、ここでも中性アミノ酸トランスポーターLAT1、LAT2を介して血液脳関門を通過することで2)、脳を傷害します。胎盤関門も同様の機構により通過するため、胎児の脳はメチル水銀の標的となりやすいと考えられています。メチル水銀は、タンパク質の活性中心となっているCys残基へ結合し活性を低下させる機構により毒性を発揮することが知られています。古典的には、チューブリン3)やアミノアシルtRNA合成酵素4),5)などのCys残基への結合を介した活性阻害が報告されています。最近では、血漿中においてセレン含有タンパク質であるセレノプロテインP (SeP) との結合が報告され6)、セレノシステインとメチル水銀の結合も、毒性発現に関与が示唆されています。他方、水銀蓄積に伴いセレンも蓄積することが知られ7)、セレンはメチル水銀毒性に対して保護的に作用するとも考えられています。
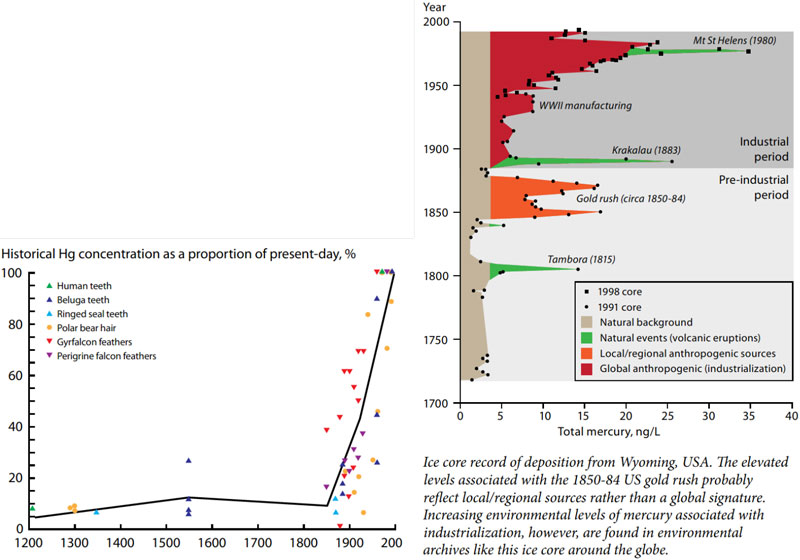
※ Atmos. Chem. Phys., 17, 5393–5406, 2017
doi: 10.5194/acp-17-5393-2017
※ UNEP Global Mercury Assessment 2018参照
https://www.unep.org/resources/publication/global-mercury-assessment-2018
引用文献:
- 1)
- 薬事・食品衛生審議会食品衛生分科会、乳肉水産食品部会: 「妊婦への魚介類の摂食と水銀に関する注意事項」平成17年11月2日 (平成22年6月1日改訂)
- 2)
- Yin, Z., Jiang, H., Syversen, T., Rocha, JB., Farina, M. and Aschner, M. (2008). The methylmercury-L-cysteine conjugate is a substrate for the L-type large neutral amino acid transporter. J Neurochem. 107(4), 1083-90.
doi: 10.1111/j.1471-4159.2008.05683.x - 3)
- Cheung, M.K. and Verity, M.A. (1985). Experimental methyl mercury neurotoxicity: locus of mercurial inhibition of brain protein synthesis in vivo and in vitro. J Neurochem. 44(6), 1799-808.
doi: 10.1111/j.1471-4159.1985.tb07171.x - 4)
- Vogel, D.G., Margolis, R.L. and Mottet, N.K. (1985) The effects of methyl mercury binding to microtubules. Toxicol Appl Pharmacol. 80(3), 473-86.
doi: 10.1016/0041-008X(85)90392-8 - 5)
- Vogel, D.G., Margolis, R.L. and Mottet, N.K. (1989). Analysis of methyl mercury binding sites on tubulin subunits and microtubules. Pharmacol Toxicol. 64(2),196-201.
doi: 10.1111/j.1600-0773.1989.tb00630.x - 6)
- Liu, Y., Zhang, W., Zhao, J., Lin, X., Liu, J., Cui, L., Gao, Y., Zhang, T.L., Li, B. and Li, Y.F. (2018). Selenoprotein P as the major transporter for mercury in serum from methylmercury-poisoned rats. J Trace Elem Med Biol. 50, 589-595.
doi: 10.1016/j.jtemb.2018.04.013 - 7)
- Naganuma, A. and Imura, N. (1980). Bis(methylmercuric) selenide as a reaction product from methylmercury and selenite in rabbit blood. Res Commun Chem Pathol Pharmacol. 27(1), 163-73.
2022年 東北大学 薬学部薬学研究科 代謝制御薬学分野
工藤 琉那、斎藤 芳郎
メチル水銀の末梢神経毒性
末梢神経は感覚神経と運動神経に大別されます。感覚神経はその細胞体を後根神経節(Dorsal root ganglion: DRG)に有し、その軸索を求心性(脊髄や脳など中枢組織に向かう方向)および遠心性(皮膚など末梢組織に向かう方向)に投射して、体の内外からの様々な感覚情報(痛み、温度、触覚、筋や腱の張力)を中枢に伝達する役割を持っています。一方で、運動神経は細胞体を脊髄に有し、軸索を筋肉に投射して収縮信号を筋肉に伝達しています。メチル水銀は強い中枢神経毒性を示すことが知られており、水俣病の原因物質として同定されて以降、多くの研究が中枢神経系をターゲットにして進められてきました。一方水俣病患者の剖検結果より、末梢感覚神経線維が選択的に傷害されるのに対し、末梢運動神経はあまり強い影響を受けないことが報告されていました1, 2)。
これまでのメチル水銀の末梢神経毒性研究において複数の研究室から報告された動物実験による形態学的・生理学的影響としては、DRG神経細胞3, 4)(図1)や感覚神経軸索4, 5)(図2)、髄鞘6, 7)が傷害され、電気伝導度低下が観察されること5, 8)、これらの現象は感覚神経優位であり運動神経ではあまり観察されないこと4, 5)、DRGや感覚神経線維に炎症応答9)やマクロファージの浸潤が観察されること4, 10)、種々の感覚障害が観察されること11-13)など、水俣病患者で見られた表現型に近いものが見出されています。また、分子細胞学的影響としては、感覚神経優位な傷害の分子機序としてメチル水銀を細胞内に取り込むトランスポーターLAT1(L-type amino acid transporter 1)が感覚神経に多く発現する一方で、メチル水銀の細胞外排出を担うとされるMRP2(Multi-drug resistance protein 2)の発現量は少ないとする報告14)、メチル水銀は感覚神経細胞のGABA電流を減少させ、非特異的カチオンチャネルを活性化するが、他の電位依存性イオンチャネルには影響しないとする報告15)、電位依存性Ca16), K, Naチャネル全てを不可逆的に阻害するとする報告17)、メチル水銀によりGABAの細胞内取込み(取り込む細胞は神経細胞の周囲を取り囲んでいるサテライトグリア細胞)が阻害されるとする報告18)などがなされています。
以上の報告にあるように、水俣病患者の示す感覚障害には末梢神経障害も考慮する必要性が示されており、末梢神経に対するメチル水銀の毒性研究についての今後のさらなる研究が待たれます。
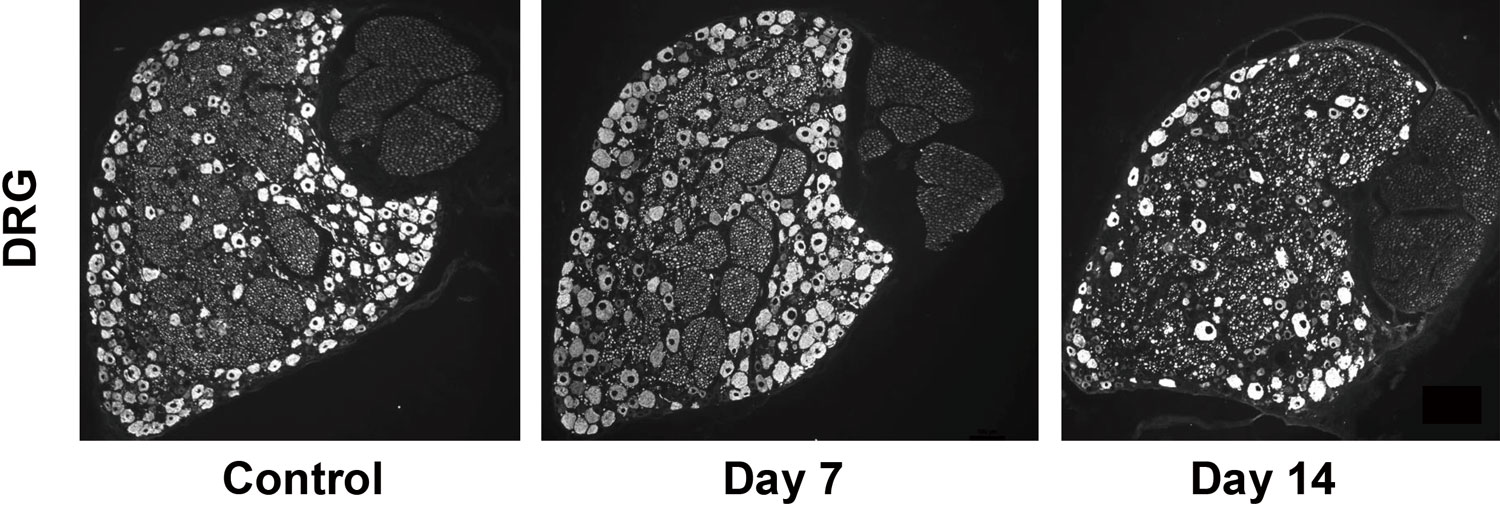
投与開始2週目(Day 14)において神経細胞マーカーであるNeurofilament陽性細胞の減少が観察される。
Controlは同週齢の未投与ラット。
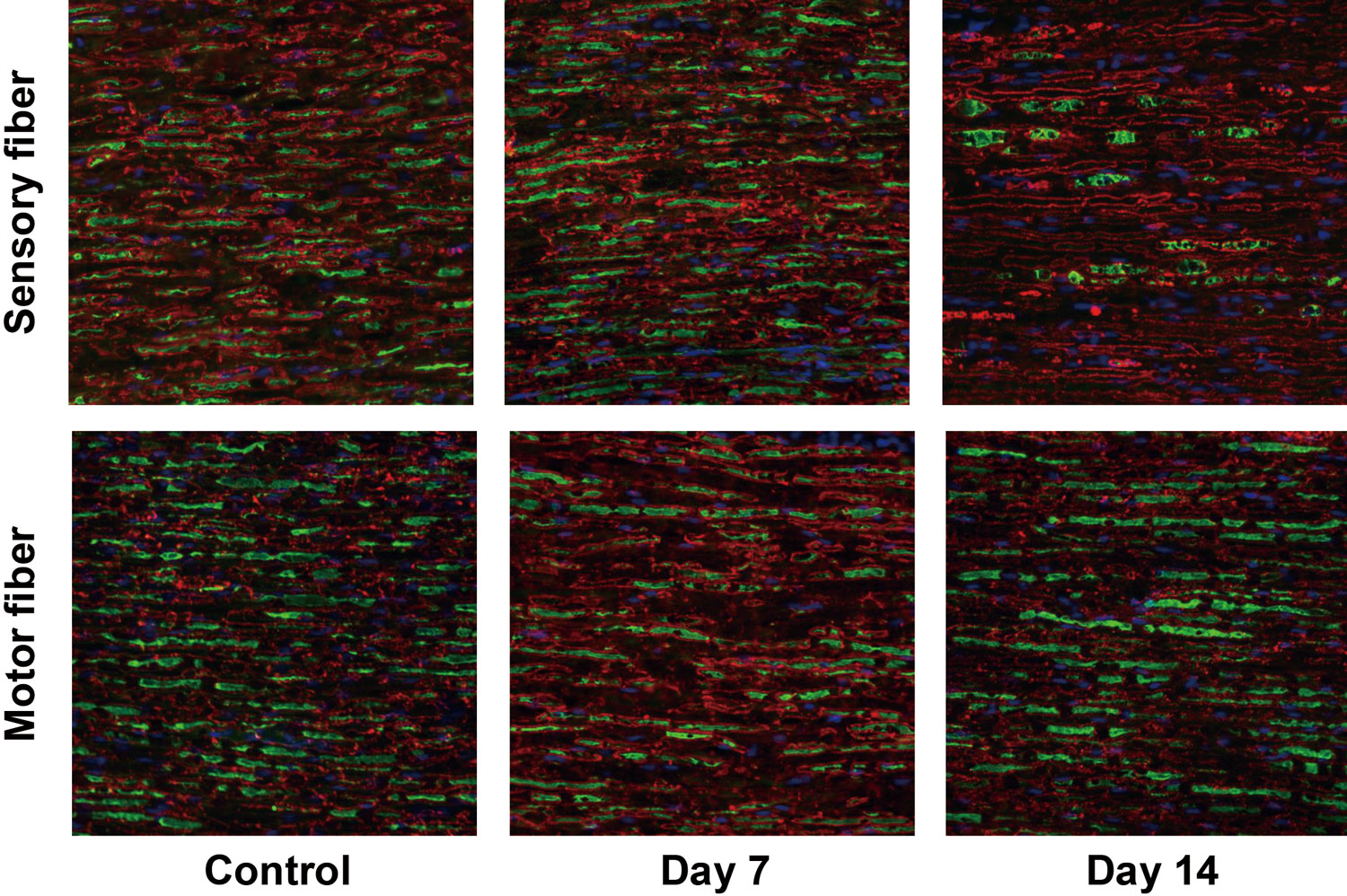
投与開始2週目(Day 14)において感覚神経線維のみ軸索脱落およびワーラー変性がみられる。
青:核、緑:軸索、赤:髄鞘(ミエリン)染色像
引用文献:
- 1)
- Eto, K. and Takeuchi, T. (1978): A pathological study of prolonged cases of Minamata disease. With particular reference to 83 autopsy cses. Acta Pathol. Jpn., 28, 565-584.
doi: 10.1111/j.1440-1827.1978.tb00896.x - 2)
- Takeuchi, T., Eto, K., Oyanag, S. and Miyajima, H. (1978): Ultrastructural changes of human sural nerves in the neuropathy induced by intrauterine methylmercury poisoning (so-called fetal Minamata disease). Virchows Arch. B Cell Pathol., 27, 137-154.
doi: 10.1007/BF02888989 - 3)
- Sakamoto, M., Wakabayashi, K., Kakita, A., Hitoshi, T., Adachi, T. and Nakano, A. (1998): Widespread neuronal degeneration in rats following oral administration of methylmercury during the postnatal developing phase: a model of fetal-type minamata disease. Brain Res., 784, 351-354.
doi: 10.1016/s0006-8993(97)01400-5 - 4)
- Shinoda, Y., Ehara, S., Tatsumi, S., et al. (2019): Methylmercury-induced neural degeneration in rat dorsal root ganglion is associated with the accumulation of microglia/macrophages and the proliferation of Schwann cells. J. Toxicol. Sci., 44, 191-199.
doi: 10.2131/jts.44.191 - 5)
- Arimura, K., Murai, Y., Rosales, R.L. and Izumo, S. (1988): Spinal roots of rats poisoned with methylmercury: physiology and pathology. Muscle Nerve, 11, 762-768.
doi: 10.1002/mus.880110713 - 6)
- Miyakawa, T., Deshimaru, M., Sumiyoshi, S., et al. (1970): Experimental organic mercury poisoning--pathological changes in peripheral nerves. Acta Neuropathol., 15, 45-55.
doi: 10.1007/BF00690688 - 7)
- Munro, I.C., Nera, E.A., Charbonneau, S.M., Junkins, B. and Zawidzka, Z. (1980): Chronic toxicity of methylmercury in the rat. J. Environ. Pathol. Toxicol., 3, 437-447.
- 8)
- Somjen, G.G., Herman, S.P. and Klein, R. (1973): Electrophysiology of methyl mercury poisoning. J. Pharmacol. Exp. Ther., 186, 579-592.
- 9)
- Shinoda, Y., Tatsumi, S., Yoshida, E., et al. (2019): Gene expression profiles in the dorsal root ganglia of methylmercury-exposed rats. J. Toxicol. Sci., 44, 549-558.
doi: 10.2131/jts.44.549 - 10)
- Nagashima, K. (1997): A review of experimental methylmercury toxicity in rats: neuropathology and evidence for apoptosis. Toxicol. Pathol., 25, 624-631.
doi: 10.1177/019262339702500613 - 11)
- Shinoda, Y., Yamada, Y., Yoshida, E., et al. (2021): Hypoalgesia and recovery in methylmercury-exposed rats. J. Toxicol. Sci., 46, 303-309.
doi: 10.2131/jts.46.303 - 12)
- Chuu, J.J., Liu, S.H. and Lin-Shiau, S.Y. (2007): Differential neurotoxic effects of methylmercury and mercuric sulfide in rats. Toxicol. Lett., 169, 109-120.
doi: 10.1016/j.toxlet.2006.12.006 - 13)
- Wu, M.F., Ison, J.R., Wecker, J.R. and Lapham, L.W. (1985): Cutaneous and auditory function in rats following methyl mercury poisoning. Toxicol. Appl. Pharmacol., 79, 377-388.
doi: 10.1016/0041-008x(85)90136-x - 14)
- Yoshida, E., Aoki, K., Sasaki, Y., et al. (2024): Comparative study of susceptibility to methylmercury cytotoxicity in cell types composing rat peripheral nerves: a higher susceptibility of dorsal root ganglion neurons. J. Toxicol. Sci., 49, 241-248.
doi: 10.2131/jts.49.241 - 15)
- Arakawa, O., Nakahiro, M. and Narahashi, T. (1991): Mercury modulation of GABA-activated chloride channels and non-specific cation channels in rat dorsal root ganglion neurons. Brain Res., 551, 58-63.
doi: 10.1016/0006-8993(91)90913-g - 16)
- Leonhardt, R., Pekel, M., Platt, B., Haas, H.L. and Busselberg, D. (1996): Voltage-activated calcium channel currents of rat DRG neurons are reduced by mercuric chloride (HgCl2) and methylmercury (CH3HgCl). Neurotoxicology, 17, 85-92.
- 17)
- Leonhardt, R., Haas, H. and Busselberg, D. (1996): Methyl mercury reduces voltage-activated currents of rat dorsal root ganglion neurons. Naunyn Schmiedebergs Arch. Pharmacol., 354, 532-538.
doi: 10.1007/BF00168447 - 18)
- Araki, K., Wakabayashi, M., Sakimura, K., et al. (1981): Decreased uptake of GABA by dorsal ganglia in methylmercury-treated rats. Neurotoxicology, 2, 557-566.
2024年 東京薬科大学 薬学部 公衆衛生学教室
篠田 陽
MDMA
3,4-メチレンジオキシメタンフェタミン(3,4-methylenedioxymethamphetamine)で、合成麻薬である。下記に示すような化学構造を有し、関連化合物として脱メチル化体ともいえるMDAおよびN-エチル体のMDEAがある。いずれも幻覚作用と中枢興奮作用を有する。日本において、錠剤型麻薬としてのMDMA乱用が増え始めたと推察されるのは、平成10年前後からと考えられるが、ここ数年錠剤の押収量(数)や検挙者が著しく増加しており、社会的問題である。作用機構としては、セロトニンなど神経伝達物質の遊離と取り込み阻害で、ドパミンの遊離作用は弱いとされている。MDMA乱用の問題は、錠剤型麻薬として知られており、種々の剤型があり、さらにカラフルな色調であることなどから、安易に服用される危険性がある。実際には、剤型中のMDMAの含量が必ずしも明らかでないことや、覚せい剤など他の物質も混在することが知られており、中毒事故につながる可能性も高い。急性中毒では、錯乱、不安、頻脈、体温上昇(40度前後の高熱を発症)、肝、腎障害、心臓障害(心不全など)、CPK上昇、筋硬直、横紋筋融解症、こん睡、けいれんなど、様々な症状が発症する。これらの症状は、悪性症候群、セロトニン症候群とほぼ類似している。
耐性、精神依存性、身体依存性も知られている。MDMAによる神経傷害は、不可逆的とされており、その障害機構は、MDMAやMDA代謝物とグルタチオンのチオエーテル抱合体によると考えられている。実験的には、チオエーテル抱合体のラット脳室内(icv)投与により、セロトニン、ドパミン、ノルエピネフリン遊離などによる”セロトニン症候群”を引き起こすことが明らかにされている。さらに、長期にわたるセロトニンの枯渇、GFAP発現上昇、ミクログリア活性化が認められている。
簡易分析で用いられるシモン反応では、MDMAと覚せい剤メタンフェタミンが、ともに同様に呈色するので、注意が必要である。最終的には、機器分析による同定を行わなければならない。
日本においては、覚せい剤、大麻、錠剤型麻薬MDMAなどによる薬物乱用が大きな社会的問題となっている。乱用による中枢機能への不可逆的な障害がおこることもあり、毒性学的研究を通した科学的啓蒙活動も必要であろう。

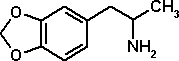
2008年 昭和大学薬学部毒物学室
吉田 武美
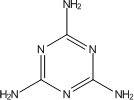
大麻 - その幻覚成分、テトラヒドロカンナビノール
大麻(アサ)およびその製品は、我が国では大麻取締法*で厳しく規制されている。大麻の乾燥葉を一般にマリファナと呼ぶ。昨今、特に大学生間での大麻の栽培を含めた乱用が顕在化しており社会問題となっている。大麻は、主成分のテトラヒドロカンナビノール(THC、図)に多幸感、陶酔感、音感・視覚の鋭敏化、時間・空間感覚の異常、離人感などを発現する作用がある。これらの異常感覚を期待し、ファッション感覚も伴って安易に乱用されている。「大麻はタバコより害が少ない」と巷間いわれるが、それは間違いである。両者の毒性は本質的に異なり、大麻の摂取量が増すとタバコには見られない急性精神症状が現れることが知られている。また、継続的に摂取すると耐性や依存性の発現のほか、統合失調症などの治療を要する精神障害にも繋がる(大麻精神病)。近年、乱用される大麻の中にはTHC含量が20%を超えるものもあり、作用がより強力で精神障害発現の危険性は増している。
大麻摂取の有無は、尿試料中のTHC代謝物であるTHC-11-oic acid の存在により判定される。検出用の簡易キット(Triage、Monitectなど)が市販されており、容易にスクリーニングが行える。最終的な確認および定量は、ガスクロマトグラフィー・質量分析装置(GC/MS)、高速液体クロマトグラフィー・質量分析装置(LC/MS)などの精密機器により行う。検出限界は0.1~1.0 ng/mLである。
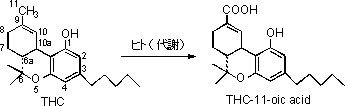
*大麻取締法では、種子は「大麻」の定義から除かれているが、発芽可能な種子を外国から持ち込むことは関税法違反である。また、その種子を栽培あるいは販売すると知りながら提供すれば、大麻取締法の栽培ほう助に当たる不法行為となる。乱用防止には、有害作用も含めてこれらを周知徹底する必要がある。
2009年 北陸大学薬学部衛生化学教室 北陸大学学術フロンティア研究組織
渡辺 和人
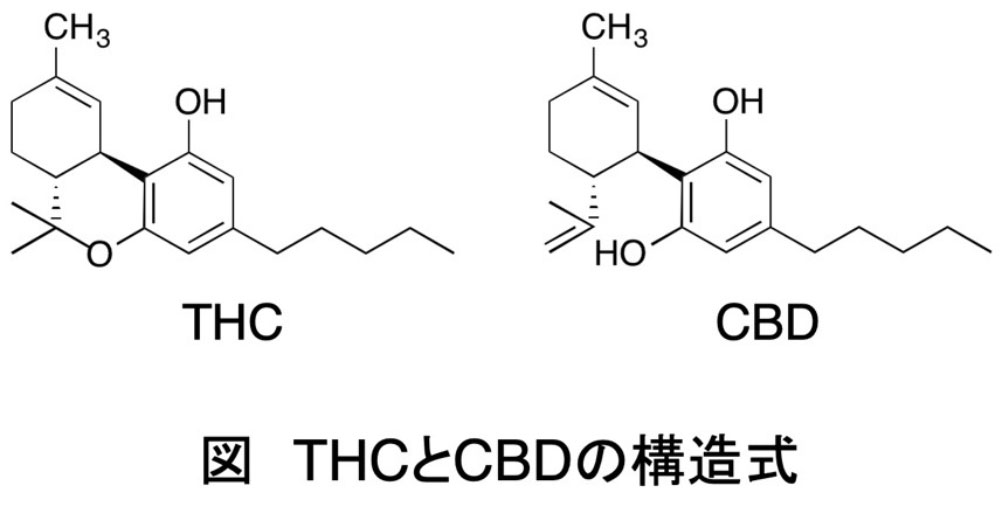
我が国における医療用大麻解禁と法規制
大麻草には120種類以上のカンナビノイド(大麻草に含まれる生理活性物質の総称)が含まれることが確認されており1)、主成分として、Δ9-テトラヒドロカンナビノール(Δ9- tetrahydrocannabinol; THC)とカンナビジオール(cannabidiol; CBD)が知られています(図)。THCは幻覚や多幸感などの精神作用を示すことから2)、多くの国で嗜好用としての使用が禁止されています。一方、CBDは精神作用や依存性を示さないため2)、大麻草から製造された医薬品、すなわち「医療用大麻」として注目されています。2018年6月、米国食品医薬品局は、大麻由来成分CBD経口薬(商品名:Epidiolex®)を難治性てんかんであるレノックス・ガストー症候群とドラベ症候群の治療薬として承認しました3)。その後、Epidiolex®は諸外国で承認を受けて使用されており、我が国でも2022年に薬事承認を見据えた治験が開始されています。しかしながら、大麻取締法により大麻草から製造された医薬品の使用が禁止されていたため、仮に医薬品として薬事承認された場合でも、医療現場で活用することができない問題を抱えていました。医療ニーズへ対応すべく、大麻草から製造された医薬品の使用に関して見直しが進められ、2023年12月に「大麻取締法」及び「麻薬及び向精神薬取締法」の一部を改正する法律が成立しました4-6)。この改正により、大麻草から製造された医薬品の使用に関する禁止規定が削除され、大麻草から製造された医薬品の医療現場での活用が可能となりました。一方、これまで使用の禁止に関する規定及び罰則が設けられていなかった大麻及びTHCですが、麻薬及び向精神薬取締法における「麻薬」と位置付けられ、不正な使用について他の規制薬物と同様に使用罪が適用されることになりました。
CBDは、レノックス・ガストー症候群とドラベ症候群以外にも、多発性硬化症、筋萎縮性側索硬化症、統合失調症、がんなど多くの疾患に対する有用性が示唆されています7-11)。したがって、日本における医療用大麻の解禁が難治性疾患の治療発展に貢献することが期待されるとともに、科学的エビデンスに基づいた医療用大麻の正しい知識の普及が必要であると考えられます。
引用文献:
- 1)
- ElSohly, M.A., Radwan, M. M., Gul, W., Chandra, S. and Galal, A. (2017) Phytochemistry of Cannabis sativa L. Prog. Chem. Org. Nat. Prod., 103, 1–36.
doi: 10.1007/978-3-319-45541-9_1 - 2)
- Pertwee, R.G. (2008) The diverse CB 1 and CB 2 receptor pharmacology of three plant cannabinoids: Δ9-tetrahydrocannabinol, cannabidiol and Δ9- tetrahydrocannabivarin. Br. J. Pharmacol. 153, 199–215.
doi: 10.1038/sj.bjp.0707442 - 3)
- FDA Food and Drug Administration. FDA Approves First Drug Comprised of an Active Ingredient Derived from Marijuana to Treat Rare, Severe Forms of Epilepsy, Updated June 25, 2018;
https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-comprised-active-ingredient-derived-marijuana-treat-rare-severe-forms - 4)
- 大麻取締法及び麻薬及び向精神薬取締法の一部を改正する法律の成立について.
https://www.mhlw.go.jp/content/11121000/001206962.pdf - 5)
- 大麻取締法.
https://www.mhlw.go.jp/web/t_doc?dataId=81108000&dataType=0&pageNo=1 - 6)
- 麻薬及び向精神薬取締法.
https://www.mhlw.go.jp/web/t_doc?dataId=81102000&dataType=0&pageNo=1 - 7)
- Pisanti, S., Malfitano, A.M., Ciaglia, E., Lamberti, A., Ranieri, R., Cuomo, G., Abate, M., Faggiana, G., Proto, M. C., Fiore, D., Laezza, C. and Bifulco, M. (2017) Cannabidiol: State of the art and new challenges for therapeutic applications. Pharmacol. Ther. 175, 133–150.
doi: 10.1016/j.pharmthera.2017.02.041 - 8)
- Morgan, C.J. and Curran, H.V. (2008) Effects of cannabidiol on schizophrenia-like symptoms in people who use cannabis. Br. J. Psychiatry 192, 306–307.
doi: 10.1192/bjp.bp.107.046649 - 9)
- Ligresti, A., Moriello, A.S., Starowicz, K., Matias, I., Pisanti, S., De Petrocellis, L., Laezza, C., Portella, G., Bifulco, M. and Di Marzo, V. (2006) Antitumor activity of plant cannabinoids with emphasis on the effect of cannabidiol on human breast carcinoma. J. Pharmacol. Exp. Ther. 318, 1375–1387.
doi: 10.1124/jpet.106.105247 - 10)
- Lal, S., Shekher, A., Puneet, Narula, A.S., Abrahamse, H. and Gupta, S.C. (2021) Cannabis and its constituents for cancer: History, biogenesis, chemistry and pharmacological activities. Pharmacol. Res. 163, 105302.
doi: 10.1016/j.phrs.2020.105302 - 11)
- Takeda, S., Okajima, S., Miyoshi, H., Yoshida, K., Okamoto, Y., Okada, T., Amamoto, T., Watanabe, K., Omiecinski, C. J. and Aramaki, H. (2012) Cannabidiolic acid, a major cannabinoid in fiber-type cannabis, is an inhibitor of MDA-MB-231 breast cancer cell migration. Toxicol. Lett. 214, 314–319.
doi: 10.1016/j.toxlet.2012.08.029
2024年 福山大学薬学部 大学院薬学研究科
竹田 修三
微小粒子状物質(PM2.5)による中枢神経系への影響
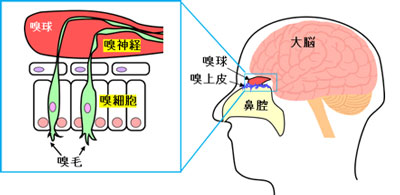
大気汚染による健康被害は世界的な懸案事項であり、現在、世界人口の92%は汚染された大気中で生活していると言われています1)。大気中を浮遊する有害物質の中でも特に、微小粒子状物質(particle matter 2.5; PM2.5)が問題視されています。PM2.5は「粒径が2.5 μmの粒子を50%の割合で分離できる分粒装置を用いて、より粒径の大きい粒子を除去した後に採取される微小粒子」と定義されるものであり2)、体内深部へ侵入しやすいため毒性が高いと考えられます。本邦では、PM2.5が呼吸器や循環器へ悪影響を及ぼすとの国内外の疫学知見をもとに、環境基準濃度を「1年平均 15 μg/m3 以下 かつ 1日平均 35 μg/m3 以下」に定めています。
口や鼻から体内に取り込まれたPM2.5は、気道や肺へ沈着します。そのためPM2.5による健康影響については、呼吸器や循環器に焦点が当てられてきました。しかし、鼻腔上皮の嗅粘膜に付着したPM2.5が嗅神経の軸索輸送(図)を介して脳内移行する可能性が示されるなど3,4)、新たな標的器官として“中枢神経系”が示唆されています。PM2.5が中枢神経系疾患のリスクを高めるとの疫学報告が増加しており、例えば、PM2.5高濃度環境下では脳梗塞発症後の死亡率が上昇、入院期間が延長することが複数の研究グループから報告されました5–7)。さらに、認知症8–10)、うつ病11)などのリスクを高めることも示唆されています。
このようにPM2.5は中枢神経系疾患を増悪することが明らかになりつつありますが、そのメカニズムはほとんど解明されておりません。その一つの理由として、研究する為に必要な量が確保できていない事が挙げられます。しかし、近年、大気中のPM2.5を微粒子として収集するサイクロン型捕集機が新たに開発されたことにより12)、PM2.5を細胞や動物に曝露することができるようになりました。今後はヒトを対象にした疫学研究に加えて毒性学研究を遂行することによって、PM2.5による中枢神経系への影響について分子レベルでの理解が進むことが期待されます。
引用文献:
- 1)
- World Health Organization. (2016): Ambient Air Pollution: A Global Assessment of Exposure and Burden of Disease. World Health Organization.
https://apps.who.int/iris/handle/10665/250141?locale-attribute=en&mbid=synd_yahoolife - 2)
- 今井浩孝,小椋康光. (2020): 衛生薬学(改訂第3版):基礎・予防・臨床. 南江堂. ISBN: 978-4524403721
- 3)
- Oberdörster, G., Sharp, Z., Atudorei, V. Elder, A., Gelein, R., Kreyling, W. and Cox, C. (2004): Translocation of inhaled ultrafine particles to the brain. Inhal. Toxicol., 16, 6-7, 437-445.
doi: 10.1080/08958370490439597 - 4)
- De Lorenzo, A.J.D. (2008): The olfactory neuron and the blood-brain barrier. In: Ciba Foundation Symposium - Taste and Smell in Vertebrates. Novartis Foundation symposium. pp.151-176, John Wiley & Sons, Ltd.
doi: 10.1002/9780470715369.ch9 - 5)
- Yang, W.S., Wang, X., Deng, Q., Fan, W.Y. and Wang, W.Y. (2014): An evidence-based appraisal of global association between air pollution and risk of stroke. Int. J. Cardiol., 175, 2, 307-313.
doi: 10.1016/j.ijcard.2014.05.044 - 6)
- Liu, H., Tian, Y., Xu, Y. and Zhang, J. (2017): Ambient Particulate Matter Concentrations and Hospitalization for Stroke in 26 Chinese Cities: A Case-Crossover Study. Stroke., 48, 8, 2052-2059.
doi: 10.1161/STROKEAHA.116.016482 - 7)
- Chen, G., Wang, A., Li, S., Zhao, X., Wang, Y., Li, H., Meng, X., Knibbs, L.D., Bell, M.L., Abramson, M.J., Wang, Y. and Guo, Y. (2019): Long-Term Exposure to Air Pollution and Survival After Ischemic Stroke. Stroke., 50, 3, 563-570.
doi: 10.1161/STROKEAHA.118.023264 - 8)
- Shou, Y., Huang, Y., Zhu, X., Liu, C., Hu, Y. and Wang, H. (2019): A review of the possible associations between ambient PM2.5 exposures and the development of Alzheimer’s disease. Ecotoxicol. Environ. Saf., 174, 344-352.
doi: 10.1016/j.ecoenv.2019.02.086 - 9)
- Grande, G., Ljungman, P.L.S., Eneroth, K., Bellander, T. and Rizzuto, D. (2020): Association Between Cardiovascular Disease and Long-term Exposure to Air Pollution With the Risk of Dementia. JAMA. Neurol., 77, 7, 801-809.
doi: 10.1001/jamaneurol.2019.4914 - 10)
- Patten, K.T., Valenzuela, A.E., Wallis, C., Berg, E.L., Silverman, J.L., Bein, K.J., Wexler, A.S. and Lein, P.J. (2021): The Effects of Chronic Exposure to Ambient Traffic-Related Air Pollution on Alzheimer’s Disease Phenotypes in Wildtype and Genetically Predisposed Male and Female Rats. Environ. Health Perspect., 129, 5, 57005.
doi: 10.1289/EHP8905 - 11)
- Braithwaite, I., Zhang, S., Kirkbride, J.B., Osborn, D.P.J. and Hayes, J.F. (2019): Air pollution (particulate matter) exposure and associations with depression, anxiety, bipolar, psychosis and suicide risk: A systematic review and meta-analysis. Environ. Health Perspect., 127, 12, 126002.
doi: 10.1289/ehp4595 - 12)
- Okuda, T., Isobe, R., Nagai, Y., Okahisa, S., Funato, K. and Inoue, K. (2015): Development of a high-volume PM2.5 particle sampler using impactor and cyclone techniques. Aerosol. Air. Qual. Res., 15, 3, 759-767.
doi: 10.4209/aaqr.2014.09.0194
2022年 広島大学 大学院統合生命科学研究科 生体機能化学研究室
田中美樹、石原康宏
アスベストと悪性中皮腫
アスベスト(石綿)は高い耐火性・耐熱性・耐腐食性に優れ、張力は鋼鉄よりも強く、安価で有用な物質として古くから利用されてきた天然珪酸塩鉱物繊維であり、近年まで建材・摩擦材・シール剤等として広く使用されてきました。しかし、石綿曝露が肺癌や悪性中皮腫を引き起こすことが分かり、欧米や日本においては石綿および石綿含有製品の新たな製造、輸入、使用が全面的に禁止されるに至っています。中でも悪性中皮腫は石綿曝露後約40年を経て発症する予後不良の特有な悪性疾患であることから、日本では2000年頃から増加傾向にあり、2030年頃に死亡数がピークを迎えると予測されており1)、その早期診断と治療法に関する研究が社会的課題となっています。WHOは2018年に世界で今なおアジアを中心に1億2500万人が労働現場で石綿に曝露されていると報告しています2)。また、全面禁止状態にある国々においても既存石綿含有建築物の不適切な解体や被災に起因する石綿曝露の可能性は存在し、石綿および関連疾患は国際的に大きな関心事であり続けています。悪性中皮腫は胸膜や腹膜を組織する中皮細胞に由来しますが、その長い潜伏期間に加え石綿曝露量や原発部位に特徴があります。石綿肺や肺癌が石綿高濃度曝露により引き起こされる一方、悪性中皮腫は低中濃度曝露により発症することが知られます3)。また、吸入された石綿は気管支肺胞を経て肺を覆う臓側胸膜を通過し胸腔に到達しますが、悪性胸膜中皮腫は必ず胸腔を覆う壁側胸膜から起こります。それらの事実は、石綿と悪性中皮腫の関係が単純な用量相関性に基づく発がん毒性だけでは説明できず、作用機序はより複雑であることを示唆し、その一端として石綿曝露による免疫毒性作用の影響をうける事が報告されています4)。悪性胸膜中皮腫の主な治療法は外科療法・放射線療法・化学療法の3つでしたが、長く打開策がありませんでした。しかし、2018年に免疫チェックポイント阻害薬(ICI)であるヒト型抗ヒトPD-1モノクローナル抗体(ニボルマブ)がMERIT試験※の結果を受けて保険収載され、治療への光明が見えてきました。更に、CheckMate-743試験※※の結果に基づき、2021年5月よりニボルマブ・イピリムマブ(ヒト型抗ヒトCTLA-4モノクローナル抗体)の併用療法も悪性胸膜中皮腫に適応拡大となり、予後改善が期待されます5)。一方、ICIの効果が見られない症例も少なくなく、悪性中皮腫のICI治療効果に関わる新たな知見の蓄積が待たれています。
【脚注】
※MERIT試験:進行または転移性悪性胸膜中皮腫の日本人患者に対する2次治療以降においてヒト型抗ヒトPD-1モノクローナル抗体(ニボルマブ)の有効性が確認された単群第2相試験。この結果を論拠としてニボルマブが日本における悪性胸膜中皮腫の治療薬として承認されることとなった。
※※CheckMate-743試験:未治療の悪性胸膜中皮腫患者を対象としたニボルマブとヒト型抗ヒトCTLA-4モノクローナル抗体(イピリムマブ)の併用療法を化学療法と比較評価した多施設国際共同無作為化非盲検第3相臨床試験。全生存期間の有意な延長が確認され、両薬剤の併用療法が悪性胸膜中皮腫に適応拡大されることとなった。
引用文献:
- 1)
- Murayama, T., Takahashi, K., Natori, Y. and Kurumatani, N. (2006): Estimation of future mortality from pleural malignant mesothelioma in Japan based on an age-cohort model. Am. J. Ind. Med., 49, 1-7.
doi: 10.1002/ajim.20246 - 2)
- https://knowledge-action-portal.com/en/content/asbestos-elimination-asbestos-related-diseases
- 3)
- Bohlig, H., Otto, H. Asbest und Mesotheliom: Fakten, Fragen, Umweltprobleme. Stuttgart: G. Thieme Verlag; 1975.
- 4)
- Nishimura, Y., Kumagai-Takei, N., Lee, S., Yoshitome, K., Ito, T., Otsuki, T. Asbestos fiber and immunological effects: Do immunological effects play any role in asbestos-related diseases? In: Kijima T, Nakano T, editors. Malignant Pleural Mesothelioma; Advances in Pathogenesis, Diagnosis, and Treatments. Respiratory Disease Series: Diagnostic Tools and Disease Managements. Berlin: Springer; 2021.
- 5)
- Baas, P., Scherpereel, A., Nowak, A.K., Fujimoto, N., Peters, S., Tsao, A.S., Mansfield, A.S., Popat, S., Jahan, T., Antonia, S., Oulkhouir, Y., Bautista, Y., Cornelissen, R., Greillier, L., Grossi, F., Kowalski, D., Rodríguez-Cid, J., Aanur, P., Oukessou, A., Baudelet, C. and Zalcman, G. (2021): First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet. 397, 375-386.
doi: 10.1016/S0140-6736(20)32714-8
2026年 川崎医科大学衛生学
西村 泰光
毒性試験法
雄性生殖発生毒性評価の現状と将来
加齢や喫煙、化学物質曝露等は、雄性生殖細胞への直接影響又はそれを支持するセルトリ細胞の障害を介した間接影響により精巣毒性を誘発することがあります。その結果もたらされる精子ゲノムに生じた(エピ)変異は、継世代影響の危険因子となることが報告されています1-4)。化学物質の雄性生殖発生毒性については、様々なガイドラインにおいて参照すべき評価手法が示されており、ヒトの安全性確保に役立っておりますが、将来的に取り組むべき課題もあると思われます。
OECD の化学物質の試験に関するガイドラインのOECD TG478(遺伝毒性試験)において示されているげっ歯類を用いる優性致死試験は、シクロフォスファミド等を雄マウスに投与し無処置の雌マウスと交配させると、優性致死突然変異を誘発し胚胎児致死作用を示すことから5)、雄性生殖能の評価に利用されています。しかし、げっ歯類を用いた優性致死試験は、胚胎児致死のハザード検出力が低いという評価上の限界があること、また、試験実施上多くの動物を要することもあり6)、OECD TG478においては補助的な位置づけの試験として評価に用いることとされています。
また、医薬品の生殖発生毒性評価に係るガイドラインICH S5 (R3) においては、受胎能及び初期胚発生(FEED)試験においてHE染色を用いた精巣の病理組織学的評価や精子の性状評価、受胎能評価により、次世代影響までを考慮した雄性生殖毒性評価を行うこととされています7)。一方で、動物実験で精子性状に悪影響を及ぼすため注意喚起されているFDA承認薬235剤を対象に、ヒトでの精子毒性のエビデンスとげっ歯類の精子性状評価と受胎能評価との一致率を調査した研究論文において、その一致率は30%に満たず、現状のげっ歯類の精子性状評価と受胎能評価のみでは、ヒトへの外挿性に課題が残ることも報告されています8)。げっ歯類の雄受胎能をベースとした雄性生殖発生毒性評価のヒトへの外挿性には少なからず課題があり、精子の供給元である精子幹細胞への感受性、精子形成サイクル、回復性等の動物種差を考慮したより詳細な評価を行う必要性があるのではないかと考えられます。さらに、近年、創薬モダリティ*は多様化しており、核酸医薬品やヒト特異的抗体・多重抗体など適当な動物種を用いた毒性評価を行うことに限界がある医薬品や、数ヶ月以上にわたって影響が持続するような核酸医薬品や抗体薬等の医薬品で雄性生殖毒性評価をどのように行うべきかの課題にも今後向き合っていく必要があると思われます。抗がん剤の開発においては、患者に医薬品を早く届けることが優先されており、動物を用いた雄性生殖発生毒性に関する安全性情報は他の医薬品と比べ乏しい状況にあり、抗がん剤をより適正に使用する上で、動物試験に代わる迅速な代替評価手法の開発も今後必要な視点と思われます。
これらの課題に対応するため、より詳細な雄性生殖毒性評価として、例えば、従来の精巣の病理解析では診断が難しい免疫組織化学を用いたセルトリ細胞の形態や精子形成サイクルに着目した生殖細胞の時空間的分布変化を指標とした組織細胞生物学的評価9-11)、同一個体から非侵襲的に経時的評価を行い動物数削減に資する磁気共鳴画像(Magnetic Resonance Imaging)を用いた精巣毒性評価12)、精子の濃度・運動性等の一般の精子性状評価では検出が困難な発生能を制御する精子残存ヒストン修飾に着目した精子エピゲノム解析の改良13) 等、新たな評価基盤の構築が期待されます。また、動物実験の代替手法として、ヒト多能性幹細胞(ヒトES細胞、iPS細胞)を用いた精巣オルガノイドの再構築に向けた基礎研究が行われています14)。現状、精原細胞までの分化誘導にとどまっていますが、将来的に成熟精子までの分化誘導が確立されれば、化学物質曝露による造精機能低下から回復までを一つのin vitro試験系で予測できる可能性があります。
このように動物を用いた非侵襲的試験やin vitro試験による生殖毒性評価及び回復性の評価の基盤が整備され、既存の評価にこれらを組み合わせることにより、これまで以上に迅速かつ高精度に雄性生殖発生毒性評価を行うことが期待されます。
*創薬モダリティ:近年、低分子医薬に加え、新たな医薬品の種類として、抗体医薬、核酸医薬、遺伝子治療薬のような様々な基盤技術を利用した医薬品が開発・承認されており、医薬品開発の多様化がトレンドとなっている
引用文献:
- 1)
- Ashapkin, V., Suvorov, A., Pilsner, J., Krawetz, S. and Sergeyev, O. (2023): Age-associated epigenetic changes in mammalian sperm: implications for offspring health and development. Hum Reprod Update., 29(1), 24-44.
doi: 10.1093/humupd/dmac033 - 2)
- Beal, M.A., Yauk, C.L. and Marchetti, F. (2017): From sperm to offspring: Assessing the heritable genetic consequences of paternal smoking and potential public health impacts. Mutat Res Rev Mutat Res., 773, 26-50.
doi: 10.1016/j.mrrev.2017.04.001 - 3)
- Trigg, N.A., Skerrett-Byrne, D.A., Xavier, M.J., Zhou, W., Anderson, A.L., Stanger, S.J., Katen, A.L., De Iuliis, G.N., Dun, M.D., Roman, S.D., Eamens, A.L. and Nixon, B. (2021): Acrylamide modulates the mouse epididymal proteome to drive alterations in the sperm small non-coding RNA profile and dysregulate embryo development. Cell Rep., 37(1), 109787.
doi: 10.1016/j.celrep.2021.109787 - 4)
- Nohara, K., Nakabayashi, K., Okamura, K., Suzuki, T., Suzuki, S. and Hata, K. (2020): Gestational arsenic exposure induces site-specific DNA hypomethylation in active retrotransposon subfamilies in offspring sperm in mice. Epigenetics Chromatin., 13(1), 53.
doi: 10.1186/s13072-020-00375-3 - 5)
- OECD TG 478.「OECDの化学物質の試験に関するガイドライン−げっ歯類を用いる優性致死試験−」2016年7月29日
- 6)
- Masumura, K., Toyoda-Hokaiwado, N., Ukai, A., Gondo, Y., Honma, M. and Nohmi, T. (2016): Estimation of the frequency of inherited germline mutations by whole exome sequencing in ethyl nitrosourea-treated and untreated gpt delta mice. Genes and Environment., 38, 10.
doi: 10.1186/s41021-016-0035-y - 7)
- ICH S5 (R3) 「医薬品の生殖発生毒性評価に係るガイドライン」について 薬生薬審 発 0129 第8号. 2021年1月29日
- 8)
- Rayburn, E., Gao, L., Ding, J., Ding, H., Shao, J. and Li, H. (2018): FDA-approved drugs that are spermatotoxic in animals and the utility of animal testing for human risk prediction. J Assist Reprod Genet., 35(2), 191-212.
doi: 10.1007/s10815-017-1062-8 - 9)
- Yokota, S., Sekine, N., Wakayama, T. and Oshio, S. (2021): Impact of chronic vitamin A excess on sperm morphogenesis in mice. Andrology., 9(5), 1579-1592.
doi: 10.1111/andr.13013 - 10)
- Saito, H., Yokota, S. and Kitajima, S. (2023): Immunohistochemical analysis of the vimentin filaments in Sertoli cells is a powerful tool for the prediction of spermatogenic dysfunction. Acta Histochemica., 125 (5), In progress (July 2023).
doi: 10.1016/j.acthis.2023.152046 - 11)
- Tatehana, M., Kimura, R., Mochizuki, K., Inada, H. and Osumi, N. (2020): Comprehensive histochemical profiles of histone modification in male germline cells during meiosis and spermiogenesis: Comparison of young and aged testes in mice. PLoS One., 15(4), e0230930.
doi: 10.1371/journal.pone.0230930 - 12)
- Yokota, S., Miyaso, M., Hirai, T., Suga, K., Wakayama, T., Taquahashi, Y. and Kitajima, S. (2023): Development of a non-invasive method for testicular toxicity evaluation using a novel compact magnetic resonance imaging system. J Toxicol Sci., 48(2), 57-64.
doi: 10.2131/jts.48.57 - 13)
- Fukuda, Y., Shintomi, K., Yamaguchi, K., Fujiwara, Y. and Okada, Y. (2023): Solubilization of Mouse Sperm Chromatin for Sequencing Analyses Using a Chaperon Protein. Methods Mol Biol., 2577, 161-173.
doi: 10.1007/978-1-0716-2724-2_11 - 14)
- Hwang, Y., Suzuki, S., Seita, Y., Ito, J., Sakata, Y., Aso, H., Sato, K., Hermann, B. and Sasaki, K. (2020): Reconstitution of prospermatogonial specification in vitro from human induced pluripotent stem cells. Nat Commun., 11(1), 5656.
doi: 10.1038/s41467-020-19350-3
2023年 国立医薬品食品衛生研究所 安全性生物試験研究センター毒性部
横田 理
医薬品の生殖発生毒性試験と動物実験代替法の活用に向けた取り組み
妊娠中の母体における化学物質の影響は母体にとどまらず、子宮の中で胎盤を介して母体と密接にリンクしている胎児の個体発生にも大きく及ぶことがあります。1950年代末から60年代初めに睡眠薬やつわり薬として用いられたサリドマイドは、服用した妊婦の出生児において四肢等に奇形を示し、「サリドマイド事件」として大きな社会問題となりました1)。サリドマイド事件を契機に1963年に国内初の生殖発生毒性試験のガイドラインが発足され、1994年にはICH*1において医薬品生殖発生毒性試験ガイドライン(ICH S5)が施行されました。本ガイドラインでは、医薬品の生殖発生毒性リスクを評価するため、胚・胎児発生に関する試験(EFD*2試験)が必要とされています(一部例外を除く)。本ガイドラインは種々の修正や新規評価法などが加えられ、2021年に全面改訂されました2)。
EFD試験では、胎児の器官が形成される時期(器官形成期)に化合物を投与した後、妊娠末期に胎児を摘出し、胚・胎児の生存性、発育遅延、形態異常等について調べます。胎児の形態については、外表、内臓、骨格について検査を行います1)。ICH S5(R3)ガイドラインでは、EFD試験では動物種差の影響を考慮し、げっ歯類1種、非げっ歯類1種を用いることが求められており、一般的にラットとウサギの2種が用いられます。しかしながら、ヒト、サル、ウサギで発生毒性が認められているサリドマイドは、マウスやラットでは発生毒性に対する感受性が低く種差があることが知られており3)、毒性発現に種差が存在する場合、in vivo試験のみではヒト毒性リスク予測が困難である点が大きな課題として挙げられます。また、1群あたり約20例の妊娠動物を使用するため、多くの動物を使用すること、時間やリソースがかかることも課題の1つです。
そこで、ヒトにおける発生毒性ハザードの検出及び実験動物使用数の削減を目指して現在精力的に進められているのがEFD試験に対する「動物実験代替法」の研究です。これまでに、ラットの全胚培養、マウスES細胞*3、ゼブラフィッシュなどを用いた試験法が報告されており4)、いずれも生体における発生・分化過程における化合物の影響を模した試験法となっています。また、近年ではヒトES/iPS細胞*4を用いた動物実験代替法の開発も進められ、マウスES細胞などげっ歯類の細胞を用いた試験法では検出困難であったサリドマイドのハザードが、ヒトES/iPS細胞を用いた試験法において検出可能であることが報告されており5-8)、種差の観点からヒトリスク評価を補助する位置づけとしても期待されます。そして、ICH S5(R3)では代替法を組み入れた評価戦略が新たに明示され、代替法活用への期待はますます高まっています。これまでに様々な分化過程及び形態形成の一端に着目した代替法が報告されており、in vivo試験結果との一致率も向上しつつあります。しかしながら、代替法は化合物の希釈液や培養液への溶解性あるいは発生毒性発現機序によっては適用困難であるなどの汎用性面での課題も抱えています。今後、これらin vitro試験系研究の更なる発展によって、ヒトリスク評価、毒性機序解明、3Rs*5に貢献できる動物実験代替法としての開発と応用が期待されます。
- *1
- ICH: International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(医薬品規制調和国際会議)
- *2
- EFD: Embryo-Fetal Development(胚・胎児発生)
- *3
- ES細胞: Embryonic Stem cells(胚性幹細胞)
- *4
- iPS細胞: induced Pluripotent Stem cells(人工多能性幹細胞)
- *5
- 3Rs: Replacement(できる限り動物を供する方法に代わり得るものを利用すること)、Reduction(できる限りその利用に供される動物の数を少なくすること)、Refinement(できる限りその動物に苦痛を与えない方法によること)の3つのRを表した原則。「動物の愛護及び管理に関する法律」(平成17年法律第68号、改正法第5章第41条)
引用文献:
- 1)
- 谷村 孝 編、毒性試験講座 11,発生毒性、地人書館、ISBN: 978-4-8052-0331-6
- 2)
- ICH S5 (R3) 「医薬品の生殖発生毒性評価に係るガイドライン」について 薬生薬審 発 0129 第8号. 令和3年1月29日
- 3)
- Vargesson, N. (2015): Thalidomide-induced teratogenesis: history and mechanisms. Birth Defects Res., 105(2), 140-156.
doi: 10.1002/bdrc.21096 - 4)
- McNerney, M., Potter, D., Augustine-Rauch, K., Barrow, P., Beyer, B., Brannen, K., Engel, S., Enright, B. P., Nowland, W. S., Powles-Glover, N., Powlin, S., Schneidkraut, M. J., Stanislaus, D., Turner, K., and Graziano, M. (2021): Concordance of 3 alternative teratogenicity assays with results from corresponding in vivo embryo-fetal development studies: Final report from the International Consortium for Innovation and Quality in Pharmaceutical Development (IQ) DruSafe working group 2. Regul. Toxicol. Pharmacol., 124, 104984.
doi: 10.1016/j.yrtph.2021.104984 - 5)
- Kameoka, S., Babiarz, J., Kolaja, K., and Chiao, E. (2014): A high-throughput screen for teratogens using human pluripotent stem cells. Toxicol. Sci., 137, 76-90.
doi: 10.1093/toxsci/kft239 - 6)
- Aikawa, N. (2020): A novel screening test to predict the developmental toxicity of drugs using human induced pluripotent stem cells. J. Toxicol. Sci., 45, 187-199.
doi: 10.2131/jts.45.187 - 7)
- Zurlinden, T. J., Saili, K. S., Rush, N., Kothiya, P., Judson, R. S., Houck, K. A., Hunter, E. S., Baker, N. C., Palmer, J. A., Thomas, R. S., and Knudsen, T. B. (2020): Profiling the ToxCast library with a pluripotent human (H9) stem cell line-based biomarker assay for developmental toxicity. Tox. Sci., 174, 189-209.
doi: 10.1093/toxsci/kfaa014 - 8)
- Kanno, S., Okubo, Y., Kageyama, T., Yan, L., and Fukuda, J. (2022): Integrated fibroblast growth factor signal disruptions in human iPS cells for prediction of teratogenic toxicity of chemicals. J. Biosci. Bioeng., 133, 291-299.
doi: 10.1016/j.jbiosc.2021.12.006
2023年 中外製薬株式会社 トランスレーショナルリサーチ本部 安全性バイオサイエンス研究部
石田 萌、片桐 龍一、清川 順平
ゼブラフィッシュを用いた安全性評価について
ゼブラフィッシュは脊椎動物で、一部を除きヒトを含む哺乳類と同等の器官・組織を備えており、ヒトとの塩基配列の相同性は70%、ヒトの疾患に関連する遺伝子の約84%を有することが知られています1)。また、ライフサイクルが短く、多産(1週間に1回、約200個産卵)で動物数の確保が容易であるという実験動物としての利点を備えています。研究の多くは医学分野での病態研究や薬効評価試験への利用が盛んですが、安全性評価については古くは環境影響評価への利用が知られていました。近年、動物実験の基準理念である3Rsの普及とともに低コストでスループットが期待できるin vivoモデルとして注目を浴び、発生毒性評価への応用を中心に、種々の安全性評価モデルの検討が進められています。
ゼブラフィッシュは胚から稚魚の段階まで体が透明で、また器官形成も早いため、非侵襲的に容易に奇形の発生を観察できるという特徴があります2)。催奇形性評価は原腸形成期の胚に化合物に曝露させ、器官形成期を通して胎児期と同等の状態まで発育させるという哺乳類の胚-胎児試験(EFD)をゼブラフィッシュで再現・モデル化させたものであり、受精5日目の幼生の生存率と形態学的な異常をスコア化し、その値を基に催奇形性ポテンシャルの陽性・陰性を決定します。このようなゼブラフィッシュを発生毒性評価に用いた報告は多く、特に2014年の欧州にて実施された複数施設でのバリデーション試験では82%と高い予測精度を示しました3)。その後、いくつかの論文が報告され、観察方法の統一の必要性など標準化への課題があるものの、ICH S5(R3)作成の過程でその利用が議論される等、現行の哺乳動物を用いた催奇形性評価の代替法として注目されています2)。
続いて、痙攣評価についても、医薬品の初期探索研究段階で利用されるケースがあります。ゼブラフィッシュの脳の構造は哺乳類に比べると単純ですが、主要な神経伝達物質やその受容体の発現は認められている上に1)、ヒトのてんかん病態モデルとして研究利用が先行していたこともあり、医薬品の痙攣評価への応用が注目されました。稚魚の頭部の電気的活動を非侵襲的に記録する多電極アレイを用いた電気生理学的な手法4)や、稚魚の催痙攣物質に対する自発運動量の増加と特異的な行動パターンに注目した行動評価5)が報告されています。簡便さとスループットの面では後者の方が優れているものの、ヒトや動物で観察される行動上の類似性、即ち“表面妥当性”(face validity)に基づいたフェノタイプアッセイであり、必ずしも原因(メカニズム)の類似性に基づいてはいないため、研究者はそのことを理解して利用する必要があります。
その他、心臓で蛍光を発する遺伝子組換えゼブラフィッシュを利用して、心臓の形態変化を外側から観察する試み6)や、病理学的検査で眼毒性を検出する試み7)や聴覚毒性物質に曝露された際に変化する走流行動(rheotaxis behavior)に注目し聴覚毒性を検出する試み8)等の研究も報告されており、安全性評価への応用も示唆されています。しかしながら、ゼブラフィッシュの生理学的特徴や生体外異物の吸収・分布・代謝・排泄に関する情報といった実験動物としての基礎情報が不足していることや、マウスやラットに比べてヒトの遺伝子との相同性に劣るという点もあり、現時点では、ゼブラフィッシュに対しては“高い予測精度”を求めるのではなく、一定の精度で許容できる“探索初期スクリーニング”を目的とした使い方が主となっています。とはいうものの、ゼブラフィッシュの安全性評価に関する論文は10年前の約4倍にも増えており、今後の基礎研究の発展とともに、安全性研究での活用場面も徐々に広がることが期待されます。
引用文献:
- 1)
- Miyawaki, I. (2020): Application of zebrafish to safety evaluation in drug discovery. J. Toxicol. Pathol., 33, 197-210.
doi: 10.1293/tox.2020-0021 - 2)
- Song, Y.S., Dai, M.Z., Zhu, C.X., Huang, Y.F., Liu, J., Zhang, C.D., Xie, F., Peng, Y., Zhang, Y., Li, C.Q. and Zhang, L.J. (2021): Validation, Optimization, and Application of the Zebrafish Developmental Toxicity Assay for Pharmaceuticals Under the ICH S5(R3) Guideline. Front. Cell Dev. Biol., 9, 721130.
doi: 10.3389/fcell.2021.721130 - 3)
- Ball, J.S., Stedman D.B., Hillegass, J.M., Zhang, C.X., Panzica-Kelly, J., Coburn, A., Enright, B.P., Tornesi, B., Amouzadeh, H.R., Hetheridge, M., Gustafson, A.L. and Augustine-Rauch, K.A. (2014): Fishing for Teratogens: A Consortium Effort for a Harmonized Zebrafish Developmental Toxicology Assay. Toxicol. Sci., 139, 210-219.
doi: 10.1093/toxsci/kfu017 - 4)
- Meyer, M., Dhamne, S.C., LaCoursiere, C.M., Tambunan, D., Poduri, A. and Rotenberg, A. (2016): Microarray Noninvasive Neuronal Seizure Recordings from Intact Larval Zebrafish. PLoS One., 11, e0159472.
doi: 10.1371/journal.pone.0156498 - 5)
- Koseki, N., Deguchi, J., Yamashita, A., Miyawaki, I. and Funabashi, H. (2014): Establishment of a novel experimental protocol for drug-induced seizure liability screening based on a locomotor activity assay in zebrafish. J. Toxicol. Sci., 39, 579-600.
doi: 10.2131/jts.39.579 - 6)
- Umemoto, N., Nishimura, Y., Shimada, Y., Yamanaka, Y., Kishi, S., Ito, S., Okamori, K., Nakamura, Y., Kuroyanagi, J., Zhang, Z., Zang, L., Wang, Z., Nishimura, N. and Tanaka, T. (2013): Fluorescent-based methods for gene knockdown and functional cardiac imaging in zebrafish. Mol. Biotechnol., 55, 131-142.
doi: 10.1007/s12033-013-9664-6 - 7)
- Cassar, S., Dunn, C. and Ramos, M.F. (2021): Zebrafish as an Animal Model for Ocular Toxicity Testing: A Review of Ocular Anatomy and Functional Assays. Toxicol. Pathol., 49, 438-454.
doi: 10.1177/0192623320964748 - 8)
- Todd, D.W., Philip, R.C., Niihori, M., Ringle, R.A., Coyle, K.R., Zehri, S.F., Zabala, L., Mudery, J.A., Francis, R.H., Rodriguez, J.J. and Jacob, A. (2017): A Fully Automated High-Throughput Zebrafish Behavioral Ototoxicity Assay. Zebrafish, 14, 331-342.
doi: 10.1089/zeb.2016.1412
2024年 住友ファーマ株式会社 前臨床研究ユニット
宮脇 出
SENDとは
SEND(Standard for Exchange of Nonclinical Data)とは、CDISC(Clinical Data Interchange Standards Consortium)1)が策定した非臨床試験データの標準形式です2)。審査の迅速化や高質化を目的として、FDAでは一部の非臨床試験データの提出様式として採用されました。対象となる試験種は、単回・反復投与毒性試験及びがん原性試験から安全性薬理試験や生殖発生毒性試験、さらに遺伝毒性試験へと徐々に拡大されています3)。SENDデータ作成の際には、Controlled Terminology(CT;統制用語)の使用が求められます4)。
SENDデータをFDAに提出する際、FDAガイダンス「Study Data Technical Conformance Guide(sdTCG)」に従うことが求められ5)、define.xmlやnSDRG(Nonclinical Study Data Reviewer’s Guide)と合わせて提出する必要があります。define.xmlはデータ項目や定義を記したmachine readableなファイルで、nSDRGは試験背景やデータ注釈を説明する文書です。これらをSENDデータとともに提出することにより、FDA審査担当者がデータの内容をより理解しやすくなり、審査の円滑化が期待されます。
2024年11月時点でFDA以外にSENDの提出を義務化している規制当局はありませんが、EMA及びSwissmedic(スイス医療庁)がパイロット提出を受け付けており6,7)、今後の動向が注目されます。また、SENDデータは規制当局への提出以外にも、試験データの可視化や複数試験の結果を比較する際に利用することが可能なため、試験効率とデータの有効活用を促進することが期待されます。
引用文献:
- 1)
- AMED.CDISCへの加盟、活動状況.CDISC入会の経緯と活動.
https://www.amed.go.jp/aboutus/collaboration/cdisc.html (accessed 27 Nov 2024) - 2)
- CDISC SENDIG v3.1.1. 2021.
https://www.cdisc.org/standards/foundational/send/sendig-v3-1-1 (accessed 07 Nov 2024) - 3)
- FDA. Data Standards Catalog v10.4. 2024.
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/data-standards-catalog (accessed 07 Nov 2024) - 4)
- NIH. SEND Terminology. 2024.
https://evs.nci.nih.gov/ftp1/CDISC/SEND/ (accessed 07 Nov 2024) - 5)
- FDA. Study Data Technical Conformance Guide (sdTCG) v5.9. 2024.
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/study-data-technical-conformance-guide-technical-specifications-document (accessed 07 Nov 2024) - 6)
- EMA. Standard for the Exchange of Nonclinical Data (SEND) proof of concept study. 2024.
https://ec.europa.eu/newsroom/ema/items/818409/en (accessed 07 Nov 2024) - 7)
- Swissmedic. SEND data sets for new authorisation applications for human medicinal products with new active substances. 2024.
https://www.swissmedic.ch/swissmedic/en/home/humanarzneimittel/authorisations/information/send-datensaetze-na-neue-ws.html (accessed 07 Nov 2024)
2024年 エーザイ(株)グローバルレギュラトリー非臨床部
佐藤 玄
標的臓器と毒性発現
抗体医薬品によるサイトカイン放出症候群およびそのリスク評価法
サイトカイン放出症候群(cytokine release syndrome, CRS)は抗体医薬品の重篤な副作用として知られており、免疫細胞の過剰な活性化により血中サイトカイン濃度が急激に上昇し、発熱、頭痛、呼吸困難、頻脈、血圧変動などの症状が起こり、死に至る場合もあります1)。CRSは、CD28スーパーアゴニスト抗体TGN1412の臨床試験で発生した大事故をきっかけに注目されるようになりました2)。しかしながら、TGN1412によるCRSの兆候はサルを用いた動物試験では認められません。動物試験は、ヒト免疫系との種差によりCRSの予測性が非常に低いと考えられています2,3)。
一方、ヒト細胞を用いたin vitro試験法はCRSリスク評価に有用とされており、TGN1412事件以降は、ヒト細胞を用いたin vitro試験法がCRSリスク評価に使用されています4,5)。例えば(1)液相抗体と全血を用いた方法や(2)固相化抗体と末梢血単核細胞(PBMC)を用いた方法などがあります4,6-9)。(1)は全血液成分を含んでおり操作が簡便、抗体依存性細胞傷害(ADCC)活性を持つalemtuzumabに対する感度が高い一方で、TGN1412に対する感度は高くありません7,8)。alemtuzumabはリンパ球等に発現するCD52に結合し、NK細胞のFcγRを架橋してサイトカイン放出を起こしますが10)、この反応はもともと血中で起こる薬理反応に起因しており、(1)の全血中で感度良く検出できます。一方、全血中のT細胞は組織中のT細胞に比べてCD28刺激に対する反応性が弱いため9,11)、全血を用いた(1)の方法ではTGN1412に対する感度が高くありません。(2)では固相化抗体が標的分子を架橋してシグナルを入れることができるため、TGN1412などシグナリング抗体に対する反応を高感度に検出できます4,6,7)。しかし、固相化抗体による標的非依存的なFcγR架橋により偽陽性反応が起こりやすくなっています12-15)。他にも、(3)PBMCを高密度で前培養する方法や11,16)、(4)血管内皮細胞や抗原発現細胞と共培養する方法などがあります17-19)。TGN1412によるサイトカイン放出は、(1)~(4)のいずれの方法でも検出できますが、それぞれのCRSリスク評価法には利点と限界があるため、抗体医薬品の作用メカニズムを理解し、適切な方法を用いてCRSリスクを評価することが重要です。
近年、TGN1412は、ヒト細胞を用いたin vitro試験法を用いて臨床試験用量を1/1000に再設定され、TAB08と名前を変えて臨床試験が進められています20,21)。非臨床試験においてヒト細胞を用いたin vitro試験法で潜在的CRSリスクを評価し、臨床試験において慎重な用量設定を行うことで、予期せぬCRS発生による事故を防げるようになってきています22)。しかし、臨床用量・重症度・個人差の予測はまだ難しいのが現状です。また、CRSに伴う神経毒性(Immune effector cell-associated neurotoxicity syndrome、ICANS)23)や肝毒性24)などの副作用の予測やメカニズムの理解も不十分であり、今後の研究の進展が期待されます。
引用文献:
- 1)
- Bugelski, P.J., Achuthanandam, R., Capocasale, R.J., Treacy, G. and Bouman-Thio, E. (2009): Monoclonal antibody-induced cytokine-release syndrome. Expert. Rev. Clin. Immunol., 5, 499-521.
doi: 10.1586/eci.09.31 - 2)
- Suntharalingam, G., Perry, M.R., Ward, S., et al. (2006): Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N. Engl. J. Med., 355, 1018-1028.
doi: 10.1056/NEJMoa063842 - 3)
- Hanke, T. (2006): Lessons from TGN1412. Lancet, 368, 1569-1570; author reply 1570.
doi: 10.1016/S0140-6736(06)69651-7 - 4)
- Stebbings, R., Findlay, L., Edwards, C., et al. (2007): "Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. J. Immunol., 179, 3325-3331.
doi: 10.4049/jimmunol.179.5.3325 - 5)
- Hansel, T.T., Kropshofer, H., Singer, T., Mitchell, J.A. and George, A.J. (2010): The safety and side effects of monoclonal antibodies. Nat. Rev. Drug. Discov., 9, 325-338.
doi: 10.1038/nrd3003 - 6)
- Thorpe, S.J., Stebbings, R., Findlay, L., Eastwood, D., Poole, S. and Thorpe, R. (2013): How predictive are in vitro assays for cytokine release syndrome in vivo? A comparison of methods reveals worrying differences in sensitivity and frequency of response. Cytokine, 64, 471-472.
doi: 10.1016/j.cyto.2013.07.009 - 7)
- Vessillier, S., Eastwood, D., Fox, B., et al. (2015): Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials--Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. J. Immunol. Methods, 424, 43-52.
doi: 10.1016/j.jim.2015.04.020 - 8)
- Iwata, Y., Harada, A., Hara, T., et al. (2016): Is an in vitro whole blood cytokine assay useful to detect the potential risk of severe infusion reaction of monoclonal antibody pharmaceuticals? J. Toxicol. Sci., 41, 523-531.
doi: 10.2131/jts.41.523 - 9)
- Eastwood, D., Findlay, L., Poole, S., et al. (2010): Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells. Br. J. Pharmacol., 161, 512-526.
doi: 10.1111/j.1476-5381.2010.00922.x - 10)
- Wing, M.G., Moreau, T., Greenwood, J., Smith, R.M., Hale, G., Isaacs, J., Waldmann, H., Lachmann, P.J., and Compston, A. (1996): Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. J. Clin. Invest. 98, 2819-2826.
doi: 10.1172/JCI119110 - 11)
- Romer, P.S., Berr, S., Avota, E., et al. (2011): Preculture of PBMCs at high cell density increases sensitivity of T-cell responses, revealing cytokine release by CD28 superagonist TGN1412. Blood, 118, 6772-6782.
doi: 10.1182/blood-2010-12-319780 - 12)
- Foreback, J.L., Remick, D.G., Crockett-Torabi, E. and Ward, P.A. (1997): Cytokine responses of human blood monocytes stimulated with Igs. Inflammation, 21, 501-517.
doi: 10.1023/a:1027359629838 - 13)
- Wing, M. (2008): Monoclonal antibody first dose cytokine release syndromes-mechanisms and prediction. J. Immunotoxicol., 5, 11-15.
doi: 10.1080/15476910801897433 - 14)
- Grimaldi, C., Finco, D., Fort, M.M., et al. (2016): Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine, 85, 101-108.
doi: 10.1016/j.cyto.2016.06.006 - 15)
- Iwata, Y., Harada, A., Kubo, C., Inoue, T., Tabo, M. and Mishima, M. (2018): Different players generate positive responses in two in vitro cytokine assay formats with aqueous and immobilized TGN1412 analog. Biochem. Biophys. Res. Commun., 502, 91-97.
doi: 10.1016/j.bbrc.2018.05.125 - 16)
- Hussain, K., Hargreaves, C.E., Roghanian, A., et al. (2015): Upregulation of FcgammaRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood, 125, 102-110.
doi: 10.1182/blood-2014-08-593061 - 17)
- Van De Vyver, A.J., Marrer-Berger, E., Wang, K., Lehr, T. and Walz, A.C. (2021): Cytokine Release Syndrome By T-cell-Redirecting Therapies: Can We Predict and Modulate Patient Risk? Clin. Cancer Res., 27, 6083-6094.
doi: 10.1158/1078-0432.CCR-21-0470 - 18)
- Dhir, V., Fort, M., Mahmood, A., et al. (2012): A predictive biomimetic model of cytokine release induced by TGN1412 and other therapeutic monoclonal antibodies. J. Immunotoxicol., 9, 34-42.
doi: 10.3109/1547691X.2011.613419 - 19)
- Li, J., Piskol, R., Ybarra, R., et al. (2019): CD3 bispecific antibody-induced cytokine release is dispensable for cytotoxic T cell activity. Sci. Transl. Med., 11, eaax8861.
doi: 10.1126/scitranslmed.aax8861 - 20)
- Tkach, K. and Writer, S. (2015): TGN1412: THE NEXT GENERATION. BIOCENTURY INNOVATIONS.
https://www.biocentury.com/article/231821 - 21)
- Vandivort, T.C., Horton, D.B. and Johnson, S.B. (2020): Regulatory and strategic considerations for addressing immunogenicity and related responses in biopharmaceutical development programs. J. Clin. Transl. Sci., 4, 547-555.
doi: 10.1017/cts.2020.493 - 22)
- van Gerven, J. and Bonelli, M. (2018): Commentary on the EMA Guideline on strategies to identify and mitigate risks for first-in-human and early clinical trials with investigational medicinal products. Br. J. Clin. Pharmacol., 84, 1401-1409.
doi: 10.1111/bcp.13550 - 23)
- Siegler, E.L. and Kenderian, S.S. (2020): Neurotoxicity and Cytokine Release Syndrome After Chimeric Antigen Receptor T Cell Therapy: Insights Into Mechanisms and Novel Therapies. Front. Immunol., 11, 1973.
doi: 10.3389/fimmu.2020.01973 - 24)
- Himmels, P., Nguyen, T.T.T., Mitzner, M.C., et al. (2023): T cell-dependent bispecific antibodies alter organ-specific endothelial cell-T cell interaction. EMBO Rep., e55532.
doi: 10.15252/embr.202255532
2024年 中外製薬株式会社 トランスレーショナルリサーチ本部 安全性バイオサイエンス研究部
岩田 良香
バイオ医薬品の創薬における免疫原性評価
バイオ医薬品における免疫原性とは、抗体医薬品を始めとしたタンパク質製剤がそれ自身に対する免疫応答を惹起し、臨床において好ましくない事象を引き起こすことと定義されます1)。免疫原性により産生される抗薬物抗体(ADA)は、医薬品の動態や薬力学、薬効に影響を及ぼすほか2)、安全性に影響することもあります3)。
ADAが産生される経路は、T細胞依存的な経路と非依存的な経路に分類されます4)。T細胞依存的な経路では、T細胞は薬物を取り込んだ抗原提示細胞(APC)の主要組織適合性複合体(MHC) class IIを介した抗原提示を受けて活性化されます。活性化したT細胞がB細胞を形質細胞へと分化させることでADAは産生されます5)。一方T細胞非依存的な経路では、医薬品由来のタンパク質がB細胞を直接活性化することで形質細胞へと分化させ,ADAが産生されます。
免疫原性ポテンシャルの低い医薬品を開発するためには、以上のような免疫原性の機序に基づいた免疫反応を適切に評価する必要があり、特にT細胞依存的な経路については、創薬段階で利用可能な様々な評価法が開発されています。抗原提示細胞による取り込みは、pH依存性の蛍光ラベルで標識した医薬品を用いて、樹状細胞等のエンドソーム内に取り込まれた量を指標として評価する方法があります6)。抗原提示され得るペプチド配列の同定には、MHC関連ペプチドプロテオミクス (MAPPs)が実施されています7)。またT細胞の活性化は、その増殖やIL-2産生等を指標として評価されています8,9)。なお、免疫原性ポテンシャルを予測する各種in silicoツールも開発されています10,11)。
以上の評価系は非常に有用ではありますが、一部のバイオ医薬品に対する予測精度は未だ不十分であり、臨床における免疫原性の機序は実際にはより複雑で、未解明な点が多く存在すると思われます。免疫原性の機序をさらに深く理解するためには、多様なパラメータを取り入れつつ、複数の系を適切に組み合わせた議論が必要です5)。例えば、医薬品候補分子自体の疎水性の高さや極性の偏りといった物理化学的性状は、免疫原性ポテンシャルを引き上げる要因となり得るため、重要なポイントの一つと考えられます12,13)。他にも、宿主細胞由来タンパク質 (HCP)、分子どうしの凝集体といった製剤中に含まれる不純物の免疫原性への関与や、関連する自然免疫系活性の評価等も検討すべき課題です14-16)。加えて、免疫原性をよりいっそう理解するためには、臨床ADAの情報は量と質共に未だ不足しています。臨床情報のデータ蓄積を進めつつ、非臨床評価系の結果との照らし合わせにより予測精度をレトロスペクティブに評価し、評価系のブラッシュアップを継続的に行うことが大切です。また、多岐にわたる免疫原性に関わるパラメータの情報から、機械学習・AIによる予測モデルを作成・利用することも今後有効であると考えられます17,18)。免疫原性の予測精度の向上に向けた研究は、医薬品開発の成功確率を高めるとともに、患者さんへの安全性を高め、より優れたバイオ医薬品を届けることに繋がると期待されます。
引用文献:
- 1)
- U.S. Department of Health and Human Services Food and Drug Administration (2014), Immunogenicity Assessment for Therapeutic Protein Products.
- 2)
- Smith, A., Manoli, H., Jaw, S., Frutoz, K., Epstein, A.L., Khawli, L.A. and Theil, F.P. (2016): Unraveling the Effect of Immunogenicity on the PK/PD, Efficacy, and Safety of Therapeutic Proteins. J. Immunol. Res., 2342187.
doi: 10.1155/2016/2342187 - 3)
- Matucci, A., Nencini, F., Maggi, E. and Vultaggio, A. (2019): Hypersensitivity reactions to biologics used in rheumatology. Expert Rev. Clin. Immunol., 15(12), 1263-1271.
doi: 10.1080/1744666X.2020.1684264 - 4)
- Vaisman-Mentesh, A., Gutierrez-Gonzalez, M., DeKosky, B.J. and Wine, Y. (2020): The Molecular Mechanisms That Underlie the Immune Biology of Anti-drug Antibody Formation Following Treatment With Monoclonal Antibodies. Front. Immunol., 11, 1951.
doi: 10.3389/fimmu.2020.01951 - 5)
- Carter, P.J. and Quarmby, V. (2024): Immunogenicity risk assessment and mitigation for engineered antibody and protein therapeutics. Nat. Rev. Drug. Discov., 23, 898-913.
doi: 10.1038/s41573-024-01051-x - 6)
- Siegel, M., Padamsey, A., Bolender, A.L., Hargreaves, P., Fraidling, J., Ducret, A., Hartman, K., Looney, C.M., Bertinetti-Lapatki, C., Rohr, O., Hickling, T.P., Kraft, T.E. and Marban-Doran, C. (2024): Development and characterization of dendritic cell internalization and activation assays contributing to the immunogenicity risk evaluation of biotherapeutics. Front. Immunol., 15, 1406804.
doi: 10.3389/fimmu.2024.1406804 - 7)
- Sekiguchi, N., Kubo, C., Takahashi, A., Muraoka, K., Takeiri, A., Ito, S., Yano, M., Mimoto, F., Maeda, A., Iwayanagi, Y., Wakabayashi, T., Takata, S., Murao, N., Chiba, S. and Ishigai, M. (2018): MHC-associated peptide proteomics enabling highly sensitive detection of immunogenic sequences for the development of therapeutic antibodies with low immunogenicity. MAbs. 10(8), 1168-1181.
doi: 10.1080/19420862.2018.1518888 - 8)
- Ito, S., Ikuno, T., Mishima, M., Yano, M., Hara, T., Kuramochi, T., Sampei, Z., Wakabayashi, T., Tabo, M., Chiba, S. and Kubo, C. (2019): In vitro human helper T-cell assay to screen antibody drug candidates for immunogenicity. J. Immunotoxicol., 16(1),
125-132.
doi: 10.1080/1547691X.2019.1604586 - 9)
- Arata, Y., Motoyama, S., Yano, M., Ikuno, T., Ito, S., Matsushita, T., Takeiri, A., Nishito, Y., Yabuki, N., Mizuno, H., Sampei, Z., Mishima, M., Honda, M., Kiyokawa, J., Suzuki, H., Chiba, S., Tabo, M. and Kubo, C. (2023): Rapid in vitro assessment of the immunogenicity potential of engineered antibody therapeutics through detection of CD4+ T cell interleukin-2 secretion. mAbs, 15(1), 2253570.
doi: 10.1080/19420862.2023.2253570 - 10)
- Racle, J., Guillaume, P., Schmidt, J., Michaux, J., Larabi, A., Lau, K., Perez, M.A.S., Croce, G., Genolet, R., Coukos, G., Zoete, V., Pojer, F., Bassani-Sternberg, M., Harari, A. and Gfeller, D. (2023). Machine learning predictions of MHC-II specificities reveal alternative binding mode of class II epitopes. Immunity, 56(6), 1359–1375.e13.
doi: 10.1016/j.immuni.2023.03.009 - 11)
- Harris, C.T. and Cohen, S. (2024). Reducing Immunogenicity by Design: Approaches to Minimize Immunogenicity of Monoclonal Antibodies. BioDrugs, 38, 205–226.
doi.org/10.1007/s40259-023-00641-2 - 12)
- Ausserwöger, H., Krainer, G., Welsh, T.J., Thorsteinson, N., de Csilléry, E., Sneideris, T., Schneider, M.M., Egebjerg, T., Invernizzi, G., Herling, T.W., Lorenzen, N. and Knowles, T.P.J. (2023): Surface patches induce nonspecific binding and phase separation of antibodies, Proc. Natl. Acad. Sci. U.S.A. 120 (15) e2210332120.
doi: 10.1073/pnas.2210332120 - 13)
- Pham, N.B. and Meng, W.S. (2020): Protein aggregation and immunogenicity of biotherapeutics. Int. J. Pharm, 585, 119523
doi: 10.1016/j.ijpharm.2020.119523 - 14)
- Haile, L.A., Puig, M., Kelley-Baker, L. and Verthelyi D. (2015): Detection of innate immune response modulating impurities in therapeutic proteins. PLoS One, 10(4), e0125078.
doi: 10.1371/journal.pone.0125078 - 15)
- Lundahl, M.L.E., Fogli, S., Colavita, P.E. and Schanlan, E.M. (2021): Aggregation of protein therapeutics enhances their immunogenicity: causes and mitigation strategies. RSC Chem. Biol., 2, 1004-1020.
doi: 10.1039/D1CB00067E - 16)
- Holley, C.K., Cedrone, E., Donohue, D., Neun, B.W., Verthelyi, D., Pang, E.S. and Dobrovolskaia, M.A. (2021): An In Vitro Assessment of Immunostimulatory Responses to Ten Model Innate Immune Response Modulating Impurities (IIRMIs) and Peptide Drug Product, Teriparatide. Molecules, 26(24), 7461.
doi: 10.3390/molecules26247461 - 17)
- Shakhnovich, V., Meibohm, B., Rosenberg, A., Kierzek, A.M., Hasenkamp, R., Funk, R.S., Thalhauser, C.J., van der Graaf, P.H., Wang, M.C. and Hamuro, L. (2020): Immunogenicity in Clinical Practice and Drug Development: When is it Significant? Clin. Transl. Sci., 13, 219-223.
doi: 10.1111/cts.12717 - 18)
- Sauna, Z.E., Jawa, V., Balu-Iyer, S. and Chirmule, N. (2023): Understanding preclinical and clinical immunogenicity risks in novel biotherapeutics development. Front. Immunol., 14, 1151888.
doi: 10.3389/fimmu.2023.1151888
2025年 中外製薬株式会社 トランスレーショナルリサーチ本部 安全性バイオサイエンス研究部
曽我 皓平
化学物質の皮膚感作性リスク評価
アレルギー性接触皮膚炎には感作が成立する誘導過程とアレルギー反応が惹起される誘発過程があります。そのうち感作の誘導は、一定の曝露条件下(頻度・期間など)で用量依存的な現象であり、感作性物質ごとに固有の閾値を持つことが知られています1)。そのため、定量的リスク評価を実施して、個々の感作性物質の「安全な曝露量」を決定することが可能です2, 3)。
定量的リスク評価は3つのステップで構成されています。第1に、感作性物質に対して、感作性の誘導における最大無作用量である予測無感作誘導濃度(No Expected Sensitization Induction Level;NESIL)を決定します。NESILの決定は、HRIPT 法(Human Repeated Insult Patch Test;ヒト反復パッチテスト)やマウス LLNA 法(Local Lymph Node Assay;局所リンパ節試験)、また動物を用いないin vitro/in silico評価法の結果など、さまざまな感作性情報を考慮した証拠の重み付けに基づいています3)。NESILについては、かつて皮膚パッチテストなどの臨床データ(感作性の発生率)は濃度(%)表記で比較しても相関性がよくありませんでしたが、単位面積当たりの投与量の考え方を導入することで相関良く議論することが可能になりました4)。これは、曝露された物質によって感作性が誘導されるためには、皮膚に存在する一定数の抗原提示細胞(樹状細胞など)が活性化される必要があるという免疫学的なメカニズムで説明できます。第2に、感作性評価係数*1を適用して実験環境から実際のヒトの曝露シナリオへ外挿することにより、許容曝露量を決定します3, 5)。第3に、製品の使用頻度や期間、使用習慣、使用量などを考慮して、消費者曝露量を算出します。その上で、感作性物質の消費者曝露量が許容曝露量を超えない場合には、感作性の誘導リスクは許容されると考えることができます。尚、この許容曝露量は、アレルギー性接触皮膚炎の誘導過程のリスク評価には有用である一方で誘発過程へは適用できないことに注意が必要です。
現在この定量的リスク評価は香料素材の感作リスク評価や感作閾値の考え方に応用されていますが3, 6)、今後、長期的な臨床研究などを通して、アレルギー性接触皮膚炎の防止に対する科学的有効性をさらに検証していくことが必要と考えられています。
*1 感作性評価係数:個人間変動、製品効果、曝露頻度、皮膚状態の要素を掛け合わせることで設定3, 5)。
引用文献:
- 1)
- Basketter, D.A., Clapp, C., Jefferies, D., Safford, B., Ryan, C.A., Gerberick, F., Dearman, R.J. and Kimber, I. (2005): Predictive identification of human skin sensitization thresholds. Contact Derm. 53(5):260-267.
doi: 10.1111/j.0105-1873.2005.00707.x - 2)
- Api, A.M., Basketter, D.A., Cadby, P.A., Cano, M.F., Ellis, G., Gerberick, G.F., Griem, P., McNamee, P.M., Ryan, C.A. and Safford, R. (2008): Dermal sensitization quantitative risk assessment (QRA) for fragrance ingredients. Regul. Toxicol. Pharmacol. 52(1):3–23.
doi: 10.1016/j.yrtph.2007.10.008. - 3)
- Api, A.M., Basketter, D., Bridges, J., Cadby, P., Ellis, G., Gilmour, N., Greim, H., Griem, P., Kern, P., Khaiat, A., O'Brien J., Rustemeyer, T., Ryan, C., Safford, B., Smith, B., Vey, M, and White, I.R. (2020): Updating exposure assessment for skin sensitization quantitative risk assessment for fragrance materials. Regul. Toxicol. Pharmacol. 118:104805.
doi: 10.1016/j.yrtph.2020.104805. - 4)
- Kimber, I., Dearman, R.J., Basketter, D.A., Ryan, C.A., Gerberick, G.F., McNamee, P.M., Lalko, J. and Api, A.M. (2008): Dose metrics in the acquisition of skin sensitization: thresholds and importance of dose per unit area. Regul. Toxicol. Pharmacol. 52(1):39–45.
doi: 10.1016/j.yrtph.2008.01.010. - 5)
- Basketter, D. and Safford, B. (2016): Skin sensitization quantitative risk assessment: A review of underlying assumptions. Regul. Toxicol. Pharmacol. 74:105–16.
doi: 10.1016/j.yrtph.2015.11.013. - 6)
- Nishijo, T., Api, A.M., Gerberick, G.F., Miyazawa, M., Na, M. and Sakaguchi, H. (2022): Implementation of a dermal sensitization threshold (DST) concept for risk assessment: structure-based DST and in vitro data-based DST. Crit. Rev. Toxicol. 52(1):51-65.
doi: 10.1080/10408444.2022.2033162.
2022年 花王株式会社 安全性科学研究所
西條 拓
生殖免疫毒性という新たな概念の確立について
主要組織適合遺伝子複合体(MHC)クラスⅠ遺伝子を父親・母親双方から受け継ぐ胎児は母親にとって免疫学的にも自己ではなくセミアロ抗原を持った非自己です。そのため、母親が妊娠胎児を受け入れるためには独特な免疫機能が働いています。このとき、単に母親の免疫機能が抑制されるのではなく、実は胎児側も巧みに母親の免疫反応から逃れる仕組みを備えています。生殖毒性は、これまで生体異物が雌・雄の生殖系や内分泌系に作用することによる妊娠への悪影響と理解されてきました。これに加えて、生体異物の免疫系への作用特性によっては流産や早産などのリスクが引き起こされる可能性があります。
ヒトの胎盤形成に際して、胎児由来の絨毛外栄養膜細胞(EVT)は母親の子宮内膜に拒絶されることなく侵入します1)。一方、母親由来の子宮NK(uNK)細胞ないし脱落膜NK(dNK)細胞(CD56brightCD16-)は、細胞傷害性が末梢血のNK細胞(CD56dim/-CD16bright)に比べて弱く、血管内皮細胞増殖因子(VEGF)の産生能も備えています2)。uNK/dNK細胞はEVTと協調して子宮内膜の螺旋動脈を拡張し血流を増やし、胎児栄養膜胎盤に向けて開放循環系に再構築します。uNK/dNK細胞に対する生体異物の影響に関する報告がいくつかあります。EVTとuNK細胞はともに内因性カンナビノイドを産生しながら、カンナビノイド受容体を発現しています。内因性カンナビノイドはuNK細胞に対しても免疫調節作用を示しますが、植物性カンナビノイドは内因性カンナビノイドを介した胎盤内のホメオスタシスを崩すことによってEVTの脱落膜への侵入や螺旋動脈の再構築を阻害したりすることが報告されています3)。またdNK細胞はスフィンゴシン-1-リン酸(S1P)に対して5種ある受容体(S1PR)のうちS1PR5を優位に発現しています。S1PRを細胞質に内在化するS1PRアゴニストに曝露されたヒト胎盤中のdNK細胞においてはS1PR5の発現低下がみられ遊走能のみならずVEGFの産生能が抑制され、EVTにおいても遊走能の低下が認められています4)。素材あるいは環境化学物質に関しては、二酸化チタン・ナノ粒子あるいはポリスチレン・マイクロプラスチックの妊娠マウスへの投与によって脱落膜のNK細胞が減少し、胎盤の形成阻害や胎児吸収率の上昇が認められたとの報告があります5,6)。
母親と胎児の免疫系に関わる共同作業は他にもみられ、生体異物の免疫系に対する作用の標的になることがあります。栄養膜細胞はPD-L1を発現し7)、細胞傷害性T細胞の活性がPD-1を介して抑制されています8,9)。マウスにおいてPD-1/PD-L1経路が阻害されると胎児死亡率が増加することが報告されています10)。また、黄体からのプロゲステロンはTh2細胞からのIL-4の産生を促し11)、IL-4は合胞体性栄養膜細胞からのヒト絨毛性ゴナドトロピンの産生を刺激し妊娠の維持に寄与します12)。その結果、妊娠の初期において母親の免疫系はTh1細胞に対してTh2細胞が優位となり13,14)、胎児に対する細胞性免疫は抑制されると考えられます。生体異物の曝露によってTh1細胞の割合が増えると流産のリスクが増加することが明らかになっています15)。
生殖免疫分野の研究は近年非常に進んでいますが、生体異物が生殖免疫に及ぼす影響に関しては未だ知見が乏しく、今後この点が注目され、生殖免疫毒性研究が進展することを期待いたします。
引用文献:
- 1)
- James, J.L., Boss, A.L., Sun, C., Allerkamp, H.H. and Clark, A.R. (2022): From stem cells to spiral arteries: A journey through early placental development. Placenta, 125, 68-77.
doi: 10.1016/j.placenta.2021.11.004 - 2)
- Fraser, R. and Zenclussen, A.C. (2022): Killer timing: The temporal uterine natural killer cell differentiation pathway and implications for female reproductive health. Front. Endocrinol., 13, 904744.
doi: 10.3389/fendo.2022.904744 - 3)
- Gurm, H., Hirota, J.A. and Raha, S. (2021): Cannabinoid signalling in immune-reproductive crosstalk during human pregnancy. Biomedicines, 9, 267.
doi: 10.3390/biomedicines9030267 - 4)
- Zhang, J., Dunk, C.E. and Lye, S.J. (2013): Sphingosine signalling regulates decidual NK cell angiogenic phenotype and trophoblast migration. Hum. Reprod., 28, 3026-3037.
doi: 10.1093/humrep/det339 - 5)
- Zhang, L., Xie, X., Zhou, Y., Yu, D., Deng, Y., Ouyang, J., Yang, B., Luo, D., Zhang, D. and Kuang, H. (2018): Gestational exposure to titanium dioxide nanoparticles impairs the placentation through dysregulation of vascularization, proliferation and apoptosis in mice. Int. J. Nanomedicine, 13, 777-789.
doi: 10.2147/IJN.S152400 - 6)
- Hu, J., Qin, X., Zhang, J., Zhu, Y., Zeng, W., Lin, Y. and Liu, X. (2021): Polystyrene microplastics disturb maternal-fetal immune balance and cause reproductive toxicity in pregnant mice. Reprod. Toxicol., 106, 42-50.
doi: 10.1016/j.reprotox.2021.10.002 - 7)
- Petroff, M.G., Chen, L., Phillips, T.A., Azzola, D., Sedlmayr, P. and Hunt, J.S. (2003): B7 family molecules are favorably positioned at the human maternal-fetal interface. Biol. Reprod., 68, 1496-1504.
doi: 10.1095/biolreprod.102.010058 - 8)
- Taglauer, E.S., Yankee, T.M. and Petroff, M.G. (2009): Maternal PD-1 regulates accumulation of fetal antigen-specific CD8+ T cells in pregnancy. J. Reprod. Immunol., 80, 12–21.
doi: 10.1016/j.jri.2008.12.001 - 9)
- Morita, K., Tsuda, S., Kobayashi, E., Hamana, H., Tsuda, K., Shima, T., Nakashima, A., Ushijima, A., Kishi, H. and Saito, S. (2020): Analysis of TCR repertoire and PD-1 expression in decidual and peripheral CD8+ T Cells reveals distinct immune mechanisms in miscarriage and preeclampsia. Front. Immunol., 11, 1082.
doi: 10.3389/fimmu.2020.01082 - 10)
- Guleria, I., Khosroshahi, A., Ansari, M.J., Habicht, A., Azuma, M., Yagita, H., Noelle, R.J., Coyle, A., Mellor, A.L., Khoury, S.J. and Sayegh, M.H. (2005): A critical role for the programmed death ligand 1 in fetomaternal tolerance. J. Exp. Med., 202, 231-237.
doi: 10.1084/jem.20050019 - 11)
- Piccinni, M.P., Giudizi, M.G., Biagiotti, R., Beloni L., Giannarini, L., Sampognaro, S., Parronchi, P., Manetti, R., Annunziato, F. and Livi, C. (1995): Progesterone favors the development of human T helper cells producing Th2-type cytokines and promotes both IL-4 production and membrane CD30 expression in established Th1 cell clones. J. Immunol., 155, 128-133.
doi: 10.4049/jimmunol.155.1.128 - 12)
- Saito, S., Harada, N., Ishii, N., Morii, T., Sakakura, S., Enomoto, M., Umekage, H., Nishikawa, K., Narita, N., Nakamura, M., Sugamura, K. and Morikawa, H. (1997): Functional expression on human trophoblasts of interleukin 4 and interleukin 7 receptor complexes with a common γ chain. Biochem. Biophys. Res. Commun., 231, 429-434.
doi: 10.1006/bbrc.1997.6121 - 13)
- Lin, H., Mosmann, T.R., Guilbert, L., Tuntipopipat, S. and Wegmann, T.G. (1993): Synthesis of T helper 2-type cytokines at the maternal-fetal interface. J. Immunol., 151, 4562-4573.
doi: 10.4049/jimmunol.151.9.4562 - 14)
- Saito, S., Sakai, M., Sasaki, Y., Tanebe, K., Tsuda, H. and Michimata, T. (1999): Quantitative analysis of peripheral blood Th0, Th1, Th2 and the Th1:Th2 cell ratio during normal human pregnancy and preeclampsia. Clin. Exp. Immunol., 117, 550-555.
doi: 10.1046/j.1365-2249.1999.00997.x - 15)
- Sakakibara, M., Maeda, Y. and Nakamura, K. (2022): Fetal loss due to Th1-skewed Th1/Th2 balance with increase (not decrease) of regulatory T cells in abortion-prone mouse model. J. Toxicol. Sci., 47, 327-336.
doi: 10.2131/jts.47.327
2024年 北海道大学大学院 獣医学研究院
中村 和市
甲状腺機能かく乱を誘導する化学物質の安全性評価について
甲状腺ホルモン(TH)は、甲状腺の濾胞上皮細胞で作られて循環血液中に分泌されるアミノ酸誘導体のホルモンで、核内受容体であるTH受容体蛋白を介して細胞の代謝を亢進させます。TH受容体蛋白は全身の細胞に存在することから、全身の細胞が標的細胞と考えられます。脊椎動物では広くTHの存在が確認されており、ホルモンの化学構造に種差はなく、また分泌腺の形状や分泌様式はよく保存されていることから1)、脊椎動物の生存に非常に重要なホルモンであると考えられています。具体的なTHとしては、4個のヨード(ヨウ素)が付加したサイロキシン(テトラヨードサイロニン、T4)、T4からヨードがひとつ取れたトリヨードサイロニン(T3)が知られています。両者は実質的には同様の生理機能を発揮しますがその生理活性はT3の方が数倍強いといわれており、血中を循環するTHのほとんどはT4ですが、標的組織ではT4がT3に変換されて作用します2)。
TH産生に促進的に作用する因子として、下垂体から分泌される甲状腺刺激ホルモン(TSH)があります。このTSHのさらに上位の制御因子であるTSH放出ホルモン(TRH)は視床下部で産生されます。これらは、視床下部―下垂体―甲状腺軸と称するフィードバック機構(図1参照)を通じて血中TH濃度を巧みに調整し、生体の恒常性を保っています1, 2)。
化学物質の安全性評価の観点からは、上記の恒常性を逸脱したTHかく乱が内分泌かく乱作用のひとつとして注目されています3)。過度なTHかく乱の結果として生じる主な有害性としては発がん性4)と発達神経毒性(DNT)2)があります。従来から毒性試験では甲状腺の病理検査がおこなわれてきており、TH合成の場である甲状腺濾胞細胞の肥大や過形成さらには腫瘍を誘発する化学物質が主としてラットで検出されてきました。当該所見は、血中TH濃度の低下に起因したTSH上昇が長期間継続した場合に発現します。しかし、THの血中動態(半減期やそれに影響する結合蛋白)にはヒトとラットで明確な種差があり、ラットでは血中TH濃度が変動しやすいことから、一般的に化学物質誘発性の甲状腺腫瘍は、ヒトに比べてラットの方が発現しやすいと考えられています4)。
一方、DNTに関しては、脳の発達時期には充分なTHが不可欠であることが実験動物で確認されており2)、また、血中THがかなり低下した妊婦から生まれた児で知能指数の低下などの脳発達障害の事例が報告されたことから5)、近年、THかく乱を生じる化学物質による脳発達障害誘発の可能性が注目されています。しかしながら、THかく乱の程度と脳発達障害誘発の定量的な関係の詳細は明らかではありません2, 6, 7)。そこで、2018年にOECDは血中TH濃度の測定を各種毒性試験で必須項目と定めました3, 7)。病理検査や血中TH濃度に影響が認められた化学物質に関しては、さらにDNT試験等を実施して甲状腺かく乱による有害性の有無を精査することが欧米の規制当局から要求されます1, 2, 8)。また、近年実施された基礎研究から上記の定量的な関係性を示唆する情報も集積しつつあり、一部の結果は総説としても報告されています9)。
現在、安全性評価は使用動物数の削減と評価精度の向上を意図した新規の評価体系(New Approach Methodologies; NAMs)の構築を目指し、パラダイムシフトの渦中にあります。既存のDNT試験の実施には多大な資源(動物・時間・費用)を要し、多数の化学物質の評価には適しません8)。そこで、DNT試験に代わる評価体系の確立を目指して、産官学の専門家によって研究がおこなわれ、TH合成阻害作用や肝臓のTH代謝酵素誘導作用を検出するインビトロ試験、実験動物の胎児や新生児の血中や脳中のTH濃度を評価するインビボ試験、インシリコ評価など、発症メカニズム(すなわち作用点:図1参照)に着目した迅速で合目的な評価法の開発が進められています2, 6, 8, 10)。これらの評価法は国際的な標準化やガイドライン化は未了であるものの、欧米の規制当局からの当該データの追加要求の事例も既に散見されており、化学物質の安全性評価の実場面では「甲状腺かく乱とDNT評価」に関しては待ったなしの状況になりつつあります。上記の各種インビトロ試験法やインシリコ評価は簡便性や機動性の観点から望ましいものですが、試験結果が生体(インビボ)での影響を正しく反映できるかどうかが最大の関心事でもあります。母動物のみならず児動物においてもTHかく乱作用を検証できるインビボ試験の開発も望まれ、現在、血中TH濃度が比較的鋭敏に変動するラットを用いて種々検討されています2, 7, 10)。今後、グローバルな研究・規制動向を踏まえつつ、産官学ならびにインビボ・インビトロ・インシリコ等の研究者の密な協働により、評価体制の迅速な構築が期待されます。
引用文献:
- 1)
- EFSA and ECHA. (2018): ECHA (European Chemicals Agency) and EFSA (European Food Safety Authority) with the technical support of the Joint Research Centre (JRC). Andersson, N., Arena, M., Auteri, D., Barmaz, S., Grignard, E., Kienzler, A., Lepper, P., Lostia, A.M., Munn, S., Parra Morte, J.M., Pellizzato, F., Tarazona, J., Terron, A. and Van der Linden, S. (2018): Guidance for the identification of endocrine disruptors in the context of Regulations (EU) No 528/2012 and (EC) No 1107/2009. EFSA Journal 16(6): 5311. 135 pp.
https://doi.org/10.2903/j.efsa.2018.5311. ECHA-18-G-01-EN. Accessed January 12, 2023. - 2)
- Gilbert, M.E., O'Shaughnessy, K.L. and Axelstad, M. (2020): Regulation of thyroid- disrupting chemicals to protect the developing brain. Endocrinology, 161, 1-17.
doi: 10.1210/endocr/bqaa106 - 3)
- OECD. (2018): Revised Guidance Document 150 on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. OECD Series on Testing and Assessment, No. 150, OECD Publishing, Paris,
https://doi.org/10.1787/9789264304741-en. Accessed January 12, 2023. - 4)
- Foster, J.R., Tinwell, H. and Melching-Kollmuss, S. (2021): A review of species differences in the control of, and response to, chemical-induced thyroid hormone perturbations leading to thyroid cancer. Arch. Toxicol., 95, 807-836.
doi: 10.1007/s00204-020-02961-6 - 5)
- Sauer, U.G., Asiimwe, A., Botham, P.A., Charlton, A., Hallmark, N., Jacobi, S., Marty, S., Melching-Kollmuss, S., Palha, J.A., Strauss, V., van Ravenzwaay, B. and Swaen, G. (2020): Toward a science-based testing strategy to identify maternal thyroid hormone imbalance and neurodevelopmental effects in the progeny - part I: which parameters from human studies are most relevant for toxicological assessments? Crit. Rev. Toxicol., 50, 740-763.
doi: 10.1080/10408444.2020.1839380 - 6)
- Marty, S., Beekhuijzen, M., Charlton, A., Hallmark, N., Hannas, B.R., Jacobi, S., Melching-Kollmuss, S., Sauer, U.G., Sheets, L.P., Strauss, V., Urbisch, D., Botham, P.A. and van Ravenzwaay, B. (2021): Towards a science-based testing strategy to identify maternal thyroid hormone imbalance and neurodevelopmental effects in the progeny - part II: how can key events of relevant adverse outcome pathways be addressed in toxicological assessments? Crit. Rev. Toxicol., 51, 328-358.
doi: 10.1080/10408444.2021.1910625 - 7)
- Li, A.A., Makris, S.L., Marty, M.S., Strauss, V., Gilbert, M.E., Blacker, A., Zorrilla, L.M., Coder, P.S., Hannas, B., Lordi, S. and Schneider, S. (2019): Practical considerations for developmental thyroid toxicity assessments: What's working, what's not, and how can we do better? Regul. Toxicol. Pharmacol., 106, 111-136.
doi: 10.1016/j.yrtph.2019.04.010 - 8)
- Noyes, P.D., Friedman, K.P., Browne, P., Haselman, J.T., Gilbert, M.E., Hornung, M,W,, Barone, Jr. S., Crofton, K.M., Laws, S.C., Stoker, T.E., Simmons, S.O., Tietge, J.E. and Degitz, S.J. (2019): Evaluating chemicals for thyroid disruption: Opportunities and challenges with in vitro testing and adverse outcome pathway approaches. Environ. Health Perspect. 127, 095001-20.
doi: 10.1289/EHP5297 - 9)
- Marty, M.S., Sauer, U.G., Charlton, A., Ghaffari, R., Guignard, D., Hallmark, N., Hannas, B.R., Jacobi, S., Marxfeld, H.A., Melching-Kollmuss, S., Sheets, L.P., Urbisch, D., Botham, P.A. and van Ravenzwaay, B. (2022): Towards a science-based testing strategy to identify maternal thyroid hormone imbalance and neurodevelopmental effects in the progeny - part III: how is substance-mediated thyroid hormone imbalance in pregnant/lactating rats or their progeny related to neurodevelopmental effects? Crit. Rev. Toxicol., 52,546-617.
doi: 10.1080/10408444.2022.2130166 - 10)
- Minami, K., Suto, H., Sato, A., Ogata, K., Kosaka, T., Hojo, H., Takahashi, N., Tomiyama, N., Fukuda, T., Iwashita, K., Aoyama, H. and Yamada, T. (2023): Feasibility study for a downsized comparative thyroid assay with measurement of brain thyroid hormones and histopathology in rats: Case study with 6-propylthiouracil and sodium phenobarbital at high dose. Regul Toxicol Pharmacol. 137, 105283.
doi: 10.1016/j.yrtph.2022.105283
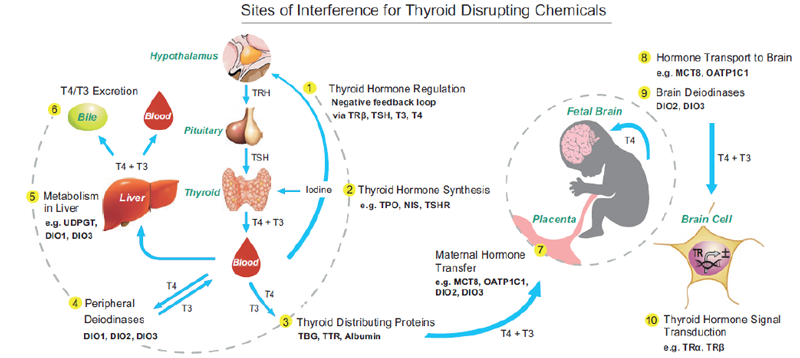
図1. 母親と胎児の甲状腺システムにおける化学物質の干渉の可能性のある部位は、図中の黄色丸の① から ⑩で示されています:①血中TH濃度制御系(視床下部 - 下垂体 - 甲状腺軸)、②TH合成、③TH分布(結合蛋白など)、④~⑥TH代謝・排泄、④および⑦~⑨TH組織濃度、および⑩THの神経細胞への作用です。化学物質は、母親、胎児および子供のこれらの部位のいくつかをかく乱させる可能性があります。尚、図1はGilbert et al. (2020): Endocrinology, 161, 1-17におけるFigure 1を著者Dr. Mary E. Gilbert (United State Environmental Protection Agency) の許可を得て掲載しています。
2023年 住友化学株式会社 生物環境科学研究所
山田 智也
低分子医薬品の創薬研究における反応性代謝物形成リスクとその評価方法
Drug-induced liver injury(DILI)は医薬品の市場からの撤退や臨床開発中止の原因として大きな割合を占めています1,2)。特に、特異体質的DILI(idiosyncratic DILI;iDILI)は臨床でしばしば認められ、重篤な副作用につながる可能性があります3,4)。したがって、医薬品開発早期にiDILIを予見することができれば、重篤な副作用の発生を防止することが期待できると共に、新薬開発の成功確率向上にもつながります。
iDILIの原因のひとつとして、反応性代謝物(Reactive Metabolite, RM)の関与が報告されており3,4)、RMの形成リスクを早期に評価することはiDILIを回避する上で重要であると考えられます3,4)。RM形成リスクの評価方法としてはCovalent binding assayがGold standardな評価方法として広く用いられていますが、評価対象化合物をRI標識する必要があるため、多くのコストと時間を要します。一方、RI標識が不要であるグルタチオン(GSH)trapping assayもRM形成リスク評価系として使用されています。GSHは細胞内に最も多く含まれる非タンパク性のチオールであり、RMや活性酸素種と反応することが報告されています5)。GSH trapping assayはGSHと代謝物の反応性を指標とした評価系であり、RM形成リスク以外にもGSH付加体の構造情報も得ることが可能です。しかし、解析が複雑なことから多検体処理には不向きです。そこで新たな評価系としてGSH consumption assayが構築されました6)。
GSH consumption assayは、GSH trapping assayと同じくGSHとの反応性を指標としたRM形成を予測する評価系ですが、GSH trapping assayと比較して測定操作が容易で多検体処理力が高いという特徴を有します6)。GSH consumption assayはRMと細胞内のGSHが反応した際に消費されるGSH量の変動を指標とした評価系になります。しかしながら、細胞内のGSH量変動は、RM発生以外の要因からも生じることが知られていることから、最終的にはGSH trapping assayやCovalent binding assayなど他のアッセイ系と組み合わせた評価が重要になります。将来的に、複数のin vitro評価系を組み合わせたRM形成リスク評価を最適化することにより、臨床開発段階から上市後に至るiDILI発生の回避に貢献することが期待されます。
引用文献:
- 1)
- Ballet, F. (1997): Hepatotoxicity in drug development: detection, significance and solutions. J. Hepatol.,26 (Suppl. 2), 26–36.
doi: 10.1016/s0168-8278(97)80494-1 - 2)
- Chen, M., Vijay, V., Shi, Q., Liu, Z., Fang, H. and Tong, W. (2011): FDA-approved drug labeling for the study of drug-induced liver injury. Drug Discov. Today, 16, 697–703.
doi: 10.1016/j.drudis.2011.05.007 - 3)
- Stachulski, A.V., Baillie, T.A., Park, B.K., Obach, R.S., Dalvie, D.K., Williams, D.P., Srivastava, A., Regan, S.L., Antoine, D.J., Goldring, C.E., Chia, A.J., Kitteringham, N. R., Randle, L.E., Callan, H., Castrejon, J.L., Farrell, J., Naisbitt, D.J. and Lennard, M.S. (2013): The generation, detection, and effects of reactive drug metabolites. Med. Res. Rev., 33, 985–1080.
doi: 10.1002/med.21273 - 4)
- Thompson, R.A., Isin, E.M., Ogese, M.O., Mettetal, J.T. and Williams, D.P. (2016): Reactive metabolites: current and emerging risk and hazard assessments. Chem. Res. Toxicol., 29, 505–533.
doi: 10.1021/acs.chemrestox.5b00410 - 5)
- Lu, S.C. (2013): Glutathione synthesis. Biochim. Biophys. Acta, 1830, 3143–3153.
doi: 10.1016/j.bbagen.2012.09.008 - 6)
- Harada, K., Kohara, H., Yukawa, T., Matsumiya, K. and Shinozawa, T. (2021): Cell-based high-throughput screening for the evaluation of reactive metabolite formation potential. Toxicol In Vitro., Aug;74:105159.
doi: 10.1016/j.tiv.2021.105159
2023年 武田薬品工業 薬剤安全性研究所
原田 幸祐
QT延長作用評価
医薬品開発において、心室再分極遅延(QT間隔延長)及び催不整脈のリスク評価は重要な課題です。1980年後半から1990年代に複数の医薬品による致死的な薬物誘発性多形性心室性頻脈(torsade's de pointes: TdP)が報告され、2000年前半にかけて、それらの薬剤は市場から撤退しました。その後の研究により、医薬品によって誘発されたTdPは、心筋細胞に発現しているhERG(human ether-a-go-go related gene、ヒト遅延整流性カリウムイオンチャネル遺伝子)チャネルを阻害したことが原因であること、また、QT間隔延長がTdPのサロゲートマーカーになることが明らかになり、「ヒト用医薬品の心室再分極遅延(QT間隔延長)の潜在的可能性に関する非臨床的評価」(ICH S7Bガイドライン)1)及び「非抗不整脈薬におけるQT/QTc間隔の延長と催不整脈作用の潜在的可能性に関する臨床的評価」(ICH E14ガイドライン)2)が厚生労働省より通知されました。ICH S7Bのガイドラインでは非臨床試験法及び統合的リスク評価について述べられており、コアバッテリー試験としてin vitro Ikr(hERG)測定とin vivo QT測定が提示されています。また、近年議論されている「QT/QTc間隔の延長と催不整脈作用の潜在的可能性に関する臨床的及び非臨床的評価に関するQ&A」(ICH E14/S7B Q&A)3)にin vivo QT試験のベストプラクティスの考慮すべき事項として、下記のものが挙げられています:
- 最適な動物種を用い、その選択の正当性を示すこと。
- 安全性薬理試験及び非げっ歯類の毒性試験は同一の動物種を使用し、心血管系の薬力学的な作用による有害性と心臓への構造的作用との関係性をより理解を深めること。
- 血中濃度を測定することが望ましく、臨床試験における最高投与量の最大血中濃度(Cmax)を網羅する十分に高い曝露で試験を実施すること。
- 一般的に覚醒自由行動下のテレメトリー機器を装着した動物が使用されるが、十分な血中曝露を得るため又は化合物特有の問題点(心拍数の変化、覚醒下動物の忍容性*1又はバイオアベイラビリティの限界*2等)に対応するために、代替モデル(例えば麻酔下又はペーシング動物*3)を用いることもありえること。
- QT間隔は心拍変動の影響を受けるため、その時点における心拍数で補正したBazett、Fridericia又はVan de Water等の補正式が用いられてきたが、近年は、精度及び感度が高いとされる個別補正式も用いられていること。
薬物によるQT間隔延長作用評価に関する臨床研究として、5つのQT延長薬物と1つの陰性対象薬物を用いたIQ-CSRC prospective early phase 1 study4)が実施され、小規模な試験でも入念なECG評価を実施することでQT間隔延長評価が可能であることが示唆されました。この臨床研究を参考に、日本安全性薬理研究会(Japanese Safety Pharmacology Society: JSPS)のワーキンググループ(Japan activity for Improvement of Cardiovascular Evaluation by Telemetry system: J-ICET)はカニクイザルを用いて試験を実施し、上記臨床試験とほぼ同様の結果を得、非臨床試験でもベストプラクティスに基づき試験を実施することで、適切なQT評価が可能であることを示しました5)。
- *1
- QT間隔延長以外の毒性が発現するため、QT間隔延長を観察するのに必要であると期待される血中濃度まで曝露できない場合など
- *2
- 吸収率が低いため期待する血中濃度まで曝露できない場合など
- *3
- 心臓に留置した電極を介して電気刺激を与えることで一定頻度で拍動する状況を作り出した状態
引用文献:
- 1)
- ICH S7B「ヒト用医薬品の心室再分極遅延(QT 間隔延長)の潜在的可能性に関する非臨床的評価」薬食審査 発 1023第 4号.平成 21 年 10 月 23 日
- 2)
- ICH E14「非抗不整脈薬におけるQT/QTc間隔の延長と催不整脈作用の潜在的可能性に関する臨床的評価」薬食審査 発 1023第 1号.平成 21 年 10 月 23 日
- 3)
- ICH E14/S7B Q&A 「Clinical and Nonclinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential, Questions and Answers 2022年2月21日バージョン」
- 4)
- Darpo, B., Benson, C., Dota, C., Ferber, G., Garnett, C., Green, C.L., Jarugula, V., Johannesen, L., Keirns, L., Krudys, K., Liu, J., Ortemann-Renon, C., Riley, S., Sarapa, N., Smith, B., Stoltz, R.R., Zhou, M., and Stockbridge, N. (2015): Results from the IQ-CSRC prospective study support replacement of the thorough QT study by QT assessment in the early clinical phase. Clin. Pharmacol. Ther., 97, 4, 326-335.
doi: 10.1002/cpt.60 - 5)
- Komatsu, R., Mizuno, H., Ishizaka, T., Ito, A., Jikuzono, T., Kakoi, T., Bando, M., Koga, T., Handa, J., Takahashi, Y., Kanno, A., Ozaki, H. and Chiba, K. (2019): Exposure-response analysis of drug-induced QT interval prolongation in telemetered monkeys for translational prediction to human. J. Pharmacol. Toxicol. Methods., 99, 106606.
doi: 10.1016/j.vascn.2019.106606
2022年 エーザイ株式会社 高度バイオシグナル安全性評価部
吉永 貴志
薬剤のイオンチャネル阻害などによるQT延長作用機序
心電図においてQT間隔は、心室筋の脱分極により興奮が開始してから再分極して興奮が収束するまでの時間(心室筋再分極時間)を表す指標となっています。このQT間隔が延長した状態が「QT延長」であり、心室頻拍や心室細動などの致死性不整脈の発症につながり突然死の原因となります。
心室筋の活動電位は細胞膜の脱分極と再分極により生じ、その特性は細胞膜を介してのNa+、Ca2+、K+などを通過させる各種イオンチャネルやトランスポーター等により制御されています。そして、イオンチャネルの遺伝子変異による機能異常は先天性のQT延長(表 1)をもたらし、薬剤等によるイオンチャネル阻害や電解質バランスの変化は二次性のQT延長の原因となります(表 2)。
心室筋が再分極する過程においては、急速に活性化するK+電流(IKr)と緩徐に活性化するK+電流(IKs)が大きく寄与しています。IKrチャネルのαサブユニットは膜6回貫通型のタンパク質でありhuman ether-a-go-go related gene(hERG)によってコードされています。このhERGチャネルのポア部分に存在するアミノ酸残基(Y652やF656など)に多くの薬剤が結合してK+の通過を阻害する結果、QT延長を誘発する事が知られています1)。そのため、創薬初期における候補薬物によるQT延長作用のin vitro評価では、IKrまたはhERGチャネル電流に対する阻害作用を検出する試験が多く実施されます。直接的なチャネル阻害作用の他にも、チャネルタンパクの細胞膜への輸送(trafficking)等に対する間接的な阻害作用や、QT延長に関わるhERGチャネル以外の心筋イオンチャネルへの阻害作用等の評価も、多様な薬物のQT延長作用を評価するためには重要となります。さらに、心筋の活動電位持続時間を測定する試験、ランゲンドルフ試験、ヒトiPS細胞由来心筋細胞を用いた試験などによってもQT延長リスク評価が行われています。In vivoでは、モルモット・イヌ・サルを用いて麻酔下および覚醒下での心電図QT間隔を測定する試験が行われています。
引用文献:
- 1)
- Mitcheson, J.S., Jun Chen, J., Lin, M., Culberson, C. and Sanguinetti, M.C. (2000): A structural basis for drug induced long QT syndrome. Proc. Natl. Acad. Sci. USA, 97, 12329-12333.
doi: 10.1073/pnas.210244497

IKs:緩徐に活性化するK+電流、IKr:急速に活性化するK+電流、INa:Na+電流、INa-K ATPase:Na+/K+ ポンプ電流、INCX:Na+-Ca2+交換機構を介する電流、IK1:内向き整流性K+電流、ICaL:L型Ca2+電流、IKACh:アセチルコリン感受性K+電流
(遺伝性不整脈の診療に関するガイドライン(2017年改訂版)より改変)

2022年 エーザイ株式会社 高度バイオシグナル安全性評価部
谷口 智彦
薬剤性腎障害のin vitro予測
薬剤性腎障害は、抗がん剤を中心として発症頻度の高い医薬品の副作用として知られています。医薬品の研究開発段階では実験動物による腎障害の予測評価が汎用されていますが、ある調査結果ではヒトで腎障害が観察された医薬品の実験動物による検出感度はげっ歯類で43%、イヌで50%との報告があり1)、実験動物による評価のみではヒトの予測は難しいのが現状です。このためヒト腎由来細胞を用いたin vitro評価系の開発が期待されています。
腎臓は様々な種類の細胞により構成されますが、そのうち近位尿細管を構成する近位尿細管上皮細胞には薬物を積極的に細胞内へ取り込む薬物トランスポーターが豊富に発現しています2)。また腎臓は高い血流と心臓に次いで2番目に高いミトコンドリアの含有量を有し3)、ミトコンドリアの薬物応答は腎臓、肝臓や心臓などの臓器での薬剤性臓器障害発症においてその重要性が指摘されています2,4,5) 。このため、近位尿細管上皮細胞は薬物の集積性と反応性が高く、細胞障害が生じやすい環境にあります。さらに動物種ごとの薬物トランスポーターの発現量や基質認識性の違いが薬物の腎臓集積性の種差を引き起こすこと、体内循環する代謝物に細胞毒性を有する薬剤があることより、薬物動態の解析は腎障害の評価・予測において重要となります2)。一方、近位尿細管上皮細胞の初代培養細胞や不死化細胞を単層培養した環境では有機アニオントランスポーターOAT1などの発現量が低下し、細胞への薬物の集積性の低下が引き起こされます。その結果として抗ウイルス薬アデフォビルなどOAT1基質による細胞毒性の検出感度が低下することが指摘されています6)。このため薬剤性腎障害のin vitro評価系を構築する際には、細胞系の薬物トランスポーター発現量を高めたり、未変化体のみならず代謝物を曝露したりするなどの工夫が必要です。
以上のことから、近年では薬物トランスポーター発現量が向上するスフェロイドモデルの開発7,8)や腎近位尿細管モデルチップ9-11)の樹立が進められています。さらに腎臓全体を評価できることが期待されるオルガノイドモデル12,13)の開発も報告されています。これらの技術開発などにより、さまざまな機序の薬剤性腎障害をin vitro評価系で予測可能な腎臓培養モデルが近い将来に社会実装されることが期待されます。
引用文献:
- 1)
- Monticello, T.M., Jones, T.W., Dambach, D.M., Potter, D.M., Bolt, M.W., Liu, M., Keller, D.A., Hart, T.K. and Kadambi, V.J. (2017): Current nonclinical testing paradigm enables safe entry to First-In-Human clinical trials: The IQ consortium nonclinical to clinical translational database. Toxicol. Appl. Pharmacol., 334, 100-109.
doi: 10.1016/j.taap.2017.09.006 - 2)
- Arakawa, H., Matsushita, K. and Ishiguro, N. (2025): Advanced in vitro evaluation of drug-induced kidney injury using microphysiological systems in drug discovery and development. Drug Metab. Pharmacokinet., 61,101056.
doi: 10.1016/j.dmpk.2025.101056 - 3)
- Pagliarini, D.J., Calvo, S.E., Chang, B., Sheth, S.A., Vafai, S.B., Ong, S.E., Walford GA, Sugiana C, Boneh A, Chen WK, Hill DE, Vidal M, Evans JG, Thorburn DR, Carr SA, and Mootha, V.K. (2008): A mitochondrial protein compendium elucidates complex I disease biology. Cell, 134, 112-123.
doi: 10.1016/j.cell.2008.06.016 - 4)
- Labbe, G., Pessayre, D. and Fromenty, B. (2008): Drug-induced liver injury through mitochondrial dysfunction: mechanisms and detection during preclinical safety studies. Fundam. Clin. Pharmacol., 22, 335-353.
doi: 10.1111/j.1472-8206.2008.00608.x - 5)
- Varga, Z.V., Ferdinandy, P., Liaudet, L. and Pacher, P. (2015): Drug-induced mitochondrial dysfunction and cardiotoxicity. Am. J. Physiol. Heart Circ. Physiol., 309, H1453-1467.
doi: 10.1152/ajpheart.00554.2015 - 6)
- Nieskens, T.T., Peters, J.G., Schreurs, M.J., Smits, N., Woestenenk, R., Jansen, K., van der
Made T.K., Röring, M., Hilgendorf, C., Wilmer, M.J. and Masereeuw, R. (2016): A Human Renal Proximal Tubule Cell Line with Stable Organic Anion Transporter 1 and 3 Expression Predictive for Antiviral-Induced Toxicity. AAPS J., 18, 465-475.
doi: 10.1208/s12248-016-9871-8 - 7)
- Ishiguro, N., Takahashi, E., Arakawa, H., Saito, A., Kitagawa, F., Kondo, M., Morinaga, G., Takatani, M., Takahashi, R., Kudo, T., Mae, S.I., Kadoguchi, M., Higuchi, D., Nakazono, Y., Tamai, I., Osafune, K. and Jimbo, Y. (2023): Improvement of Protein Expression Profile in Three-Dimensional Renal Proximal Tubular Epithelial Cell Spheroids Selected Based on OAT1 Gene Expression: A Potential In Vitro Tool for Evaluating Human Renal Proximal Tubular Toxicity and Drug Disposition. Drug Metab. Dispos., 51, 1177-1187.
doi: 10.1124/dmd.122.001171 - 8)
- Arakawa, H., Higuchi, D., Takahashi, E., Matsushita, K., Nedachi, S., Peng, H., Kadoguchi, M., Morimura, K., Araki, A., Kondo, M., Ishiguro, N., Jimbo, Y. and Tamai, I. (2024): Three-dimensional culture of human proximal tubular epithelial cells for an in vitro evaluation of drug-induced kidney injury. J Pharm Sci., 113, 3255-3264.
doi: 10.1016/j.xphs.2024.08.009 - 9)
- Jang, K.J., Mehr, A.P., Hamilton, G.A., McPartlin, L.A., Chung, S., Suh, K.Y. and Ingber, D.E. (2013): Human kidney proximal tubule-on-a-chip for drug transport and nephrotoxicity assessment. Integr. Biol (Camb)., 5, 1119-1129.
doi: 10.1039/c3ib40049b - 10)
- Jang, K.J. and Suh, K.Y. (2010): A multi-layer microfluidic device for efficient culture and analysis of renal tubular cells. Lab. Chip., 10, 36-42.
doi: 10.1039/b907515a - 11)
- Kimura, H., Nakamura, H., Goto, T., Uchida, W., Uozumi, T., Nishizawa, D., Shinha, K., Sakagami, J. and Doi, K. (2024): Standalone cell culture microfluidic device-based microphysiological system for automated cell observation and application in nephrotoxicity tests. Lab. Chip., 24, 408-421.
doi: 10.1039/d3lc00934c - 12)
- Takasato, M., Er, P.X., Chiu, H.S., Maier, B., Baillie, G.J., Ferguson, C., Parton, R.G., Wolvetang, E.J., Roost, M.S., Chuva de Sousa Lopes, S.M. and Little, M.H. (2015): Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis.
Nature, 526, 564-568.
doi: 10.1038/nature15695 - 13)
- Rizki-Safitri, A., Gupta, N., Hiratsuka, K., Kobayashi, K., Zhang, C., Ida, K., Satlin, L.M. and Morizane, R. (2022): Live functional assays reveal longitudinal maturation of transepithelial transport in kidney organoids. Front. Cell Dev. Biol., 10, 978888.
doi: 10.3389/fcell.2022.978888
2025年 名古屋市立大学大学院薬学研究科 レギュラトリーサイエンス分野
荒川 大
環境毒性
代替フロン
1974年にモリーナとローランドにより、成層圏に達したフロンが紫外線によって分解されて発生した塩素によるオゾン層破壊の可能性が指摘され、その後、冷却剤、消火剤、発泡剤、溶媒やエアゾール噴射剤等に含まれるChlorofluorocarbons (CFCs)、四塩化炭素、臭化物やハロン等によるオゾン層破壊が進んでいることが認識されるようになった。CFCsに替わって、「塩素を含まないこと、含んでいても分子内に水素を有し、成層圏に達する前に消滅しやすいこと」、「地球温暖化への影響が少ないこと」及び「可燃性と毒性がないこと」を条件とした代替フロンとして、Hydrochlorofluorocarbons (HCFCs)及びHydrofluorocarbons (HFCs)が開発され、使用されてきた。HCFCsはCFCsほどではないが、オゾン層を破壊する性質を有しており、日本をはじめとする先進国ではモントリオール議定書により2020年までに全廃することとなっている。
1,1,1,2,2-Pentafluoroethane (HFC-125), 1,1,1,2-Tetrafluoroethane (HFC-134a), 1,1,1-Trifluoroethane (HFC-143a), 1,1-Difluoroethane (HFC-152a), Difluoromethane (HFC-32) 及び1,1,1,3,3-Pentafluoropropane (HFC-245fa)等のHFCsは、CFCsに比べて低オゾン破壊能及び低温暖化効果、HCFCs及びCFCsと同様な高揮発性、高熱伝導率、低表面張力、低可燃性等を有することから、CFCs及びHCFCsの代替冷媒として広く使われている。しかし、HFCsは二酸化炭素の数百倍から数千倍の地球温暖化係数(GWP)を持つため、大気排出が地球温暖化の観点から問題視されている。2007年におけるHFCsの国内出荷量は34,300 トンであり、そのうちの24,900 トンが冷媒としての出荷である。また、環境省が公表する『日本国温室効果ガスインベントリ報告書』によれば、2007年度の冷媒用途でのHFCsの大気排出量は、1,145万GWPトン(実際の排出量とGWPとの積をとり二酸化炭素換算での排出量に変換したもの)と推定されている。これは2007年における国内からの温室効果ガス全排出量13.7億GWPトンの1%弱に相当する。HFCsの大気排出量の中でも、カーエアコン用冷媒に用いられるHFC-134aの排出量が際だって大きいと思われる。
このHFC-134aに代表されるHFCsは速やかに揮発して環境中に放出され、その大気寿命である10年程度の時間スケールで、主に二酸化炭素、一酸化炭素、トリフルオロ酢酸、フッ化カルボニル、フッ化水素及びギ酸等に分解される。これらの分解物質のうちのいくつかは強い腐食性や刺激性を有しており、毒性も有している。
EUでは2006年6月に欧州F-Gas規制が交付され、乗用車及び軽トラックのエアコンに使用する冷媒はGWPが150以下であること、また、今後6年間でHFC-134aの使用を規制することとし、2011年から販売される新車から段階的廃止を開始し、2017年1月から全ての新車への使用を禁止するとしている。
表-1. 主なHFCsの大気寿命、オゾン破壊係数(ODP)、地球温暖化係数(GWP)、暴露限界、生産量及び用途
| 化合物 | IUPAC名 | 分子式 | CAS番号 | 大気寿命(年) | ODP | GWPa | 曝露限界(ppm) | 世界の年間生産量(千トン) | 主な用途 |
|---|---|---|---|---|---|---|---|---|---|
| HFC-125 | 1,1,1,2,2-Pentafluoroethane | CHF2CF3 | 354-33-6 | 29 | 0 | 3,400 | 1,000 | 38.5 (2006年) | 市販の冷凍・空調システムの混合成分、消火剤 |
| HFC-134a | 1,1,1,2-Tetrafluoroethane | CH2FCF3 | 811-97-2 | 13.8 | 0 | 1,300 | 1,000 | 156.6 (2006年) | 単独または他の成分と混合して、家庭・車・産業用冷媒 |
| HFC-143a | 1,1,1-Trifluoroethane | CF3CH3 | 420-46-2 | 52 | 0 | 4,300 | 1,000 | 16.3 (2006年) | 市販の冷凍・空調システムの混合成分 |
| HFC-152a | 1,1-Difluoroethane | CH3CHF3 | 75-37-6 | 1.4 | 0 | 120 | 1,000 | 20.4 | 冷媒、噴霧剤、発泡剤 |
| HFC-32 | Difluoromethane | CH2F2 | 75-10-5 | 5 | 0 | 550 | 1,000 | 15.0 | 家庭空調システム |
| HFC-245fa | 1,1,1,3,3-Pentafluoropropane | CHF2CH2CF3 | 460-73-1 | 7.2 | 0 | 950 | 300 | - | 冷房システム、発泡剤 |
| a: 二酸化炭素GWP = 1として、その気体の大気中における濃度あたりの温室効果の100年間の強さを比較した値。 | |||||||||
2011年 独立行政法人 産業技術総合研究所 安全科学研究部門
江馬 眞
コンパクト化学システム研究センター
永翁 龍一
Human Biomonitoring
環境中の化学物質に人々がどのくらい曝露されているかを把握する方法として、環境モニタリングと生物モニタリングがあります。環境モニタリングの代表例として、日本全国の測定基地局での大気汚染物質の長期モニタリングがあります。一方、生物モニタリングは、生物中の化学物質や代謝物濃度を把握することであり、そのうち、人体中の化学物質濃度およびその生物学的影響に関するバイオマーカーの変化を経年的にモニタリングするのがHuman Biomonitoring(HBM)です1, 2)。
HBMの歴史には鉛が関わっています。1930年代から、鉛中毒による造血障害と関連する現象として、血中プロトポルフィリン濃度が測定されていました。1960年代以降、鉛添加ガソリンによる大気汚染が問題になった際、一般住民の血中鉛濃度が、健康影響の懸念されるレベルであることが明らかになり、鉛添加ガソリンが国際的に禁止されて以降も、欧米において一般住民の血中鉛濃度および造血関連因子のモニタリングが継続され、現在のHBMにつながっています1)。近年、低レベルの鉛曝露による小児の神経発達への影響が懸念されていますが、図に示したように、2000年以降、米国の各年齢群別の血中鉛濃度は小児も含めたすべての年齢群で経年的に低下していることがわかります3)。HBMにより人体中の化学物質濃度をモニタリングすることは、環境政策への根拠データを提供するだけでなく、政策の効果を評価するうえでも有用です。
米国でこのように政策への反映・評価に活用できるような規模のHBMが可能となっているのは国立衛生統計センターがNHANES(National Health and Nutrition Examination Survey、国民健康栄養調査)を実施しているからです。NHANESは1971年から開始され、1999年からは隔年ごとに全米から約5,000~9,000人を抽出して、栄養素だけでなく200種類以上の化学物質の血中濃度と健康情報を収集しており、そのデータは公開され、世界中の研究者が活用できます4, 5)。EUでは特にドイツでHBMが長期にわたって実施され、たとえば20種類の可塑剤について、1988年から2022年までの尿中における経年的な濃度変化が明らかにされています6)。さらに、EUの各国がばらばらにHBMを進めるのではなく、EU全体で化学物質への複合曝露の状況を把握し、環境政策に活用することを目指し、HBM4EUというプロジェクトがスタートしました7)。HBM4EUでは、すでに多くの化学物質について各国のHBMのデータの共有化、指標値の設定、測定手法の標準化が進められ、その成果として、たとえばEU諸国の尿中ビスフェノールA濃度の分布が比較検討されています8)。
わが国では、環境省がダイオキシン類のHBMを2002年から開始し、2011年からは重金属類などのHBMも実施しています9)。しかし、n数が100前後と諸外国に比べて著しく少なく、データの代表性に課題があるのが現状です。現在、日本を除くほとんどの先進国で、多くの化学物質について大規模なHBMが実施されており、日本におけるHBMの充実が望まれます10)。
引用文献:
- 1)
- Angerer, J., Ewers, U. and Wilhelm, M. (2007): Human biomonitoring: state of the art. Int. J. Hyg. Environ. Health, 210, 3-4, 201-228.
doi: 10.1016/j.ijheh.2007.01.024 - 2)
- 姫野誠一郎 (2024): 化学物質のHuman Biomonitoring. “化学物質の複合影響と健康リスク評価”. 青木康展・青山博昭(編), 医歯薬出版株式会社, 119-128. ISBN: 9784263732205
- 3)
- Tsoi, M.F., Cheung, C.L., Cheung, T.T. and Cheung, B.M. (2016): Continual decrease in blood lead level in Americans: United States National Health Nutrition and Examination Survey 1999-2014, Am. J. Med., 129, 1213-1218.
doi: 10.1016/j.amjmed.2016.05.042 - 4)
- National Health and Nutrition Examination Survey
https://www.cdc.gov/nchs/nhanes/index.html - 5)
- 中山祥嗣 (2020): 世界のHuman Biomonitoringと日本の課題:実践と政策応用. 学術の動向, 25, 11, 80-87.
doi: 10.5363/tits.25.11_80 - 6)
- Kasper-Sonnenberg, M., Pälmke, C., Wrobel, S., Brüning, T., Murawski, A., Apel, P., Weber, T., Kolossa-Gehring, M. and Koch, H.M. (2025): Plasticizer exposure in Germany from 1988 to 2022: Human biomonitoring data of 20 plasticizers from the German Environmental Specimen Bank. Environ. Int., 195, 109190.
doi: 10.1016/j.envint.2024.109190 - 7)
- Apel, P., Rousselle, C., Lange, R., Sissoko, F., Kolossa-Gehring, M. and Ougier, E. (2020): Human biomonitoring initiative (HBM4EU) - Strategy to derive human biomonitoring guidance values (HBM-GVs) for health risk assessment. Int. J. Hyg. Environ. Health, 230, 113622.
doi: 10.1016/j.ijheh.2020.113622 - 8)
- Tagne-Fotso, R., Riou, M., Saoudi, A., et al. (2024): Exposure to bisphenol A in European women from 2007 to 2014 using human biomonitoring data - The European Joint Programme HBM4EU. Environ. Int., 190, 108912.
doi: 10.1016/j.envint.2024.108912 - 9)
- 環境省, 化学物質の人へのばく露量モニタリング調査
https://www.env.go.jp/chemi/kenkou/monitoring.html - 10)
- 姫野誠一郎 (2020): 低レベル曝露の時代の人体影響評価 ─日本にもHuman Biomonitoringが必要では?. 学術の動向, 25, 11, 64-68.
doi: 10.5363/tits.25.11_64
図 NHANES(1999 ~ 2014)による血中鉛濃度の年齢群別経年変化
(引用文献10)より転載)
(各調査時の全年齢群の総数は約5,000~9,000人)
2025年 昭和医科大学 薬学部
姫野 誠一郎
動物実験代替法
MPSを用いた安全性評価の現状
Microphysiological System(MPS;生体模倣システム)とは、Organ on a Chipなどとも呼ばれ、MEMS(micro electro mechanical systems)技術を用いてプラスチックなどの素材からなる微小空間を持つチップ内に細胞あるいはオルガノイドなどを播種し、培地を灌流することで、従来の平面静置培養では得ることができない、より生体に近い機能や反応を各臓器(中枢、心臓、腎臓、肝臓、膵臓、小腸、微小血管など)で模倣できるシステムと一般的に言われています。
医薬品モダリティ*1の多様化やヒトに特異的な医薬品の開発に伴い、ますます種差を考慮した評価が求められる中、MPSは臨床予測性がより高い安全性や薬物動態の評価系として期待が寄せられています。すなわち、MPSは培地を灌流することにより起きるシェアストレス*2などにより、ヒトに近い生体機能を持つことが知られており、例えば既存のヒトの小腸細胞を用いた平面静置培養では認められない蠕動運動や微絨毛の形成などが報告されています1)。その他、欧米を中心とした種々のコンソーシアム活動などを通じて、安全性への利用事例や薬物動態評価にMPSを用いる際に求められる推奨事項が報告されています2, 3)。
MPSを用いた評価系の課題としては、MPSは生物学と工学の両要素を持つツールであることから生理的環境を再現するための条件設定の難しさが挙げられます。その他にも微量な細胞や培地を経時的かつ非侵襲に評価するための検出装置の充実なども必要です。規制科学の観点では、MPSの性能基準や評価法の標準化に向けた国際調和が行われており、MPS World Summit 4)などで産官学が一体となっての議論が進められ、今後の進展が注目されています。
- *1
- モダリティ:低分子、中分子(ペプチド)、抗体、核酸、細胞、等の様々な治療手段。近年製薬業界で使用されている用語。
- *2
- シェアストレス:せん断応力とも言われ、物質内部にある面と平行方向に、その面にすべらせるように作用する応力のこと。
引用文献:
- 1)
- Kim et al. (2012): Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12, 2165-74.
doi: 10.1039/c2lc40074j - 2)
- Marx et al. (2020): Biology-inspired microphysiological systems to advance patient benefit and animal welfare in drug development. ALTEX. 37, 365-394.
doi: 10.14573/altex.1603161 - 3)
- Fowler et al. (2020): Microphysiological systems for ADME-related applications: current status and recommendations for system development and characterization. Lab Chip. 7, 446-467.
doi: 10.1039/c9lc00857h - 4)
- Microphysiological System World Summit
https://mpsworldsummit.com/
2022年 アステラス製薬株式会社 開発研究部門
奈良岡 準
化学物質の全身毒性評価におけるin silicoの活用法
2013年にEUにおいて動物実験により評価された原料を含む化粧品の販売が禁止されたこと等を背景に、世界中で動物を用いない毒性評価法(以下,非動物評価法)が議論されています。中でも全身毒性はその応答が複雑であり、標準化された非動物評価法は確立しておりません。非動物評価法の有望な手法の一つとして、類似物質の毒性情報から評価物質の毒性を推定する“read-across”がありますが、“類似性”の定義の難しさ等の課題があります1)。一方、近年開発が続くハイスループットスクリーニング(HTS)やオミクス解析の膨大なデータの公開、またそれらを解析するin silico技術の発展により、非動物試験とin silico技術を活用した新たな非動物評価法が大きな期待を集めています。
非動物試験とin silico技術を組み合わせた非動物評価法には大きく二つの方向性が見られます。一つは、生物学的応答性を考慮したread-acrossの精度向上です。米国EPAのToxCast(最大約4,500物質×数百種のHTSデータ2))等のデータから生物学的な類似性を解析することで、化学構造から類似性を解析するよりも、read-acrossの精度が高まることが報告されています3-5)。また、米国EPAのHPにはToxCastデータから類似物質を探索する機能が公開されており6)、実際の評価への活用が期待されます(2021年11月時点はbeta版)。
もう一つは、様々なin silico予測モデルの構築です。HTSやオミクスデータは化学物質に対する生体応答のキーイベントを反映するため、定量的構造活性相関(QSAR)などの化学構造を基にした予測の課題である“化学構造と毒性予測結果の間にある生体反応に基づく毒性発現メカニズム”を考慮することができます。すなわち,ToxCast等のHTSデータを用いた臓器毒性の予測や、遺伝子発現データ、薬剤-分子相互作用情報を用いた副作用予測等により、毒性発現機序を含めた予測が可能となります7,8)。
その他にも、体内動態9,10)やPoint of Departure(POD)の算出11,12)等、全身毒性評価の様々な場面においてin silico技術は活躍しています。本解説で取り上げた様々な新技術はNew Approach Methodologies(NAMs)と総称され、適切に組み合わせて使用することで非動物評価の実現が期待されます。そして、in silico技術は、その中でも大きな役割を担っています。
引用文献:
- 1)
- ECHA (2020): The use of alternatives to testing on animals for the REACH Regulation.
doi: 10.2823/092305 - 2)
- Richard, A.M., Judson, R.S., Houck, K.A. et al. (2016): ToxCast Chemical Landscape: Paving the Road to 21st Century Toxicology. Chem Res Toxicol 29, 1225–1251.
doi: 10.1021/acs.chemrestox.6b00135 - 3)
- Ball, N., Cronin, M.T.D., Shen, J. et al. (2016): Toward Good Read-Across Practice (GRAP) Guidance. ALTEX 33, 149–166.
doi: 10.14573/altex.1601251 - 4)
- Zhu, H., Bouhifd, M., Donley, E. et al. (2016): Supporting read-across using biological data. ALTEX 33, 167–182.
doi: 10.14573/altex.1601252 - 5)
- Pawar, G., Madden, J.C., Ebbrell, D. et al. (2019): In silico toxicology data resources to support read-across and (Q)SAR. Front Pharmacol 10, 561.
doi: 10.3389/fphar.2019.00561 - 6)
- CompTox Chemical Dashboard
https://comptox.epa.gov/dashboard - 7)
- Liu, J., Patlewicz, G., Williams, A.J. et al. (2017): Predicting Organ Toxicity Using in Vitro Bioactivity Data and Chemical Structure. Chem Res Toxicol 30, 2046–2059.
doi: 10.1021/acs.chemrestox.7b00084 - 8)
- Wang, Z., Clark, N.R. and Ma’ayan, A. (2016): Drug-induced adverse events prediction with the LINCS L1000 data. Bioinformatics 32, 2338–2345.
doi: 10.1093/bioinformatics/btw168 - 9)
- Pearce, R.G., Setzer, R.W., Strope, C.L. et al. (2017): httk: R package for high-throughput toxicokinetics. J Stat Softw 79, 1–26.
doi: 10.18637/jss.v079.i04 - 10)
- OECD (2021): Guidance document on the characterisation, validation and reporting of Physiologically Based Kinetic (PBK) models for regulatory purposes. Ser Test Assess No. 331.
- 11)
- Paul Friedman, K., Gagne, M., Loo, L. H. et al. (2020): Utility of in Vitro Bioactivity as a Lower Bound Estimate of in Vivo Adverse Effect Levels and in Risk-Based Prioritization. Toxicol Sci 173, 202–225.
doi: 10.1093/toxsci/kfz201 - 12)
- Health Canada (2021): Science Approach Document Bioactivity Exposure Ratio: Application in Priority Setting and Risk Assessment.
2022年 花王株式会社 安全性科学研究所
天野 雄斗
Read-acrossを活用した安全性評価
Read-acrossとは、評価対象物質(ターゲット)の毒性を、類似の化学物質(アナログ)の既存の毒性情報から推定する手法です。動物実験における3Rs*1の広まり、EUでの化粧品指令7次改正(2003/15/EC)の公布、REACH*2など多くの規制当局での受け入れ等を背景に欧米を中心に普及は加速し、今では動物実験代替法の標準的なツールのひとつとなりました。
Read-acrossはターゲットと化学構造式が類しているアナログを収集することから始まります。化学構造の類似性に加え、物理化学的及び毒性学的性質の類似性(カテゴリーアプローチ)や、MOA(Mode of Action)や代謝経路の類似性(アナログアプローチ)等の様々な指標により、ターゲットと類した毒性をもつと考えられた物質群がアナログの候補となります1)。OECD QSAR Toolbox2)、有害性評価支援システム統合プラットフォーム(HESS)3)、COSMOS Next Generation4)など様々なread-across支援ツールの利用も可能です。十分な数のアナログと既知の毒性試験などの情報が集まれば、ターゲットが標的とする臓器など定性的な毒性ポテンシャルが推定可能となります。最近では無毒性量など定量的リスク評価の検討も報告されています5,6)。
OECD1)やECHA7)からは、信頼性の高いread-acrossを実施するためのガイダンスが示されています。しかし実際にはread-acrossはケースバイケースで判断するものであり、選出したアナログが毒性学的に妥当であるか、また、そこから推定したターゲットの毒性が妥当であるかを客観的に示すことが難しい場合が多くあります。特に選出されたアナログに、明確な標的臓器や生理活性が確認されなかった場合に、それを以てターゲットが“安全”であるという結論を導き出すというread-acrossの作業には多くの課題があります。
これら課題を解決するため、例えばOECDではIntegrated Approaches to Testing and Assessment (IATA) Case Studies Project8)が進められ、read-acrossを用いたケーススタディが次々に報告されています。また、「in silico手法」に分類されるread-acrossですが、最近では化学物質を細胞に適用した際の応答性やトランスクリプトームデータを、アナログ収集や妥当性の説明に活用する報告もされています9,10,11)。これらの検討によりread-acrossの受け入れがさらに進み、日本や世界各国での行政利用も含めた普及に繋がることが期待されています。
- *1
- 3Rs:Replacement(できる限り動物を供する方法に変わりうるものを利用すること)、Reduction(できる限りその利用に供される動物の数を少なくすること)、Refinement(できる限りその動物に苦痛を与えない方法によること)の頭文字の3つのRであり、動物実験の基本理念(「動物の愛護及び管理に関する法律の一部を改正する法律」(平成17年法律第68号、改正法第5章第41条)。
- *2
- REACH(Registration(登録)、Evaluation(評価)、Authorisation(認可) and Restriction(制限) of Chemicals(化学品)):2007年6月1日に発効したEU(欧州連合)における化学品の登録、評価、認可及び制限に関する規則。
引用文献:
- 1)
- OECD (2014): Guidance on Grouping of Chemicals, Series on Testing & Assessment, No. 194, Second Edi. Ed. Paris.
- 2)
- OECD, “QSAR Toolbox”
https://qsartoolbox.org/ (参照2021/11/10) - 3)
- 独立行政法人製品評価技術基盤機構, “有害性評価支援システム統合プラットフォーム(HESS)”
https://www.nite.go.jp/chem/qsar/hess.html (参照2021/11/10) - 4)
- Yang et al. (2021): COSMOS Next Generation – A public knowledge base leveraging chemical and biological data to support the regulatory assessment of chemicals. Comput. Toxicol. 19.
doi: 10.1016/j.comtox.2021.100175 - 5)
- Schultz et al. (2017): Read-across of 90-day rat oral repeated-dose toxicity: A case study for selected n-alkanols. Comput. Toxicol. 2, 12–19.
doi: 10.1016/j.comtox.2017.02.002 - 6)
- Hisaki et al. (2020): Integration of read-across and artificial neural network-based QSAR models for predicting systemic toxicity: A case study for valproic acid. J. Toxicol. Sci., 45, 95-108.
doi: 10.2131/jts.45.95 - 7)
- ECHA, “Read-Across Assessment Framework (RAAF)”
https://echa.europa.eu/documents/10162/13628/raaf_en.pdf/614e5d61-891d-4154-8a47-87efebd1851a (参照2021/11/10) - 8)
- OECD, “Integrated Approaches to Testing and Assessment (IATA)”
https://www.oecd.org/chemicalsafety/risk-assessment/iata-integrated-approaches-to-testing-and-assessment.htm (参照2021/11/10) - 9)
- De Abrew et al. (2019): Use of connectivity mapping to support read across: A deeper dive using data from 186 chemicals, 19 cell lines and 2 case studies. Toxicology, 423, 84-94.
doi: 10.1016/j.tox.2019.05.008 - 10)
- Nakagawa et al. (2021): Grouping of chemicals based on the potential mechanisms of hepatotoxicity of naphthalene and structurally similar chemicals using in vitro testing for read-across and its validation. Regul. Toxicol. Pharmacol., 121.
doi:10.1016/j.yrtph.2021.104874 - 11)
- 久木友花 ほか(2021)、「化粧品の次世代安全性評価-発生毒性予測におけるトランスクリプトーム解析の可能性-、第48回日本毒性学会学術年会 ポスターセッション
doi: 10.14869/toxpt.48.1.0_P-164
2022年 株式会社資生堂 ブランド価値開発研究所
久木 友花
リードアクロスによる肝毒性予測の現状と課題
肝毒性は、化学物質の主要な毒性の一つであり、その機序解明と評価系開発が進められています。これまでに、活性代謝物の生成、ミトコンドリア障害、活性酸素種の産生、脂質蓄積などの肝毒性発現機序に基づいたインビトロ評価系が開発されていますが、ゴールデンスタンダードとなる手法は開発されていません。他方、化粧品や工業化学物質、医薬品などの機能性化学物質の開発において、動物を用いない安全性評価が求められています。
そのような状況において、既存の毒性試験データを活用し、化学的・生物学的に類似した化学物質の毒性情報から、未試験の化学物質の毒性を類推する、リードアクロスという手法が、肝毒性評価に有用ではないかと期待されています。欧州化学品庁からガイドラインが発出され1)、欧州化学品規則であるREACHにおいてもリードアクロスの可能性が検討されています2)。これまでに化粧品分野を中心に、化学物質の毒性評価におけるリードアクロスの有用性を示す、多くのケーススタディが報告されています3)。肝毒性評価においては、予測代謝物の類似性評価4)、化学構造に基づく反応性代謝物の生成可能性評価並びに内分泌撹乱や肝機能・肝障害との関連が示唆されている核内受容体との反応性評価による化合物のグループ化5)、さらにはPubChemアッセイ等の公的インビトロ実験データ6)や網羅的遺伝子発現解析データ7,8)を用いた生物学的プロファイリングが、リードアクロスに用いる類似物質の選定に有用であることが報告されています。
一方で、化学物質の肝毒性をリードアクロスで予測するには課題が多いのも現状です。一つは、肝毒性の病態や表現型は多様であることです。いくつかの公的毒性データベースでは「肝毒性」という大きなエンドポイントの有無のみ搭載されていますが、実際には細胞壊死、炎症性変化、細胞増殖/過形成、細胞肥大/肝肥大、脂質蓄積/空胞変性などのより詳細なエンドポイントを考慮したリードアクロスが必要であると思われます4)。もう一つの大きな課題は類似物質の選択における客観性です。多くのケーススタディ報告では限られた数の類似物質が提示され、それらをもとに肝毒性の評価が行われていますが、実際の化学物質規制における評価においては、類似物質を客観的に選択することは非常に困難であると推察されます。これらに関連する課題として、リードアクロスにより肝毒性がないことを証明することの難しさもあります。これらの課題を解決するためには、大規模データベースを用いたケーススタディを積み重ね、実際の化学物質開発や規制の現場で試行錯誤を重ねていくことが重要だと思われます。
引用文献:
- 1)
- ECHA (2017) Read-Across Assessment Framework (RAAF).
- 2)
- Ball, N., Bars, R., Botham, P.A. et al. (2022): A framework for chemical safety assessment incorporating new approach methodologies within REACH. Arch. Toxicol., 96, 743–766.
doi: 10.1007/s00204-021-03215-9 - 3)
- Alexander-White, C., Bury, D., Cronin, M. et al. (2022): A 10-step framework for use of read-across (RAX) in next generation risk assessment (NGRA) for cosmetics safety assessment. Regul. Toxicol. Pharmacol., 129, 105094.
doi: 10.1016/j.yrtph.2021.105094 - 4)
- Bassan, A., Alves, V.M., Amberg, A. et al. (2021): In silico approaches in organ toxicity hazard assessment: Current status and future needs in predicting liver toxicity. Comput. Toxicol., 20, 100187.
doi: 10.1016/j.comtox.2021.100187 - 5)
- Wu, S., Daston, G., Rose, J. et al. (2023): Identifying chemicals based on receptor binding/bioactivation/mechanistic explanation associated with potential to elicit hepatotoxicity and to support structure activity relationship-based read-across. Curr. Res. Toxicol., 5, 100108.
doi: 10.1016/j.crtox.2023.100108 - 6)
- Zhao, L., Russo, D.P., Wang, W., Aleksunes, L.M. and Zhu, H. (2020): Mechanism-driven read-across of chemical hepatotoxicants based on chemical structures and biological data. Toxicol. Sci., 174, 178-188.
doi: 10.1093/toxsci/kfaa005 - 7)
- Nakagawa, S., Okamoto, M., Nukada, Y. and Morita, O. (2020): Comparison of the potential mechanisms for hepatotoxicity of p-dialkoxy chlorobenzenes in rat primary hepatocytes for read-across. Regul. Toxicol. Pharmacol., 113, 104617.
doi: 10.1016/j.yrtph.2020.104617 - 8)
- Nakagawa, S., Okamoto, M., Yoshihara, K., Nukada, Y. and Morita, O. (2021): Grouping of chemicals based on the potential mechanisms of hepatotoxicity of naphthalene and structurally similar chemicals using in vitro testing for read-across and its validation. Regul. Toxicol. Pharmacol., 121, 104874.
doi: 10.1016/j.yrtph.2021.104874
2024年 静岡県立大学 薬学部 衛生分子毒性学分野
吉成 浩一
AI(深層学習)を用いた毒性予測手法
近年人工知能(AI)技術の発展は目覚ましくあらゆる分野への応用が進んでいます。毒性学研究、特に新規化学物質の毒性予測についてもその応用例は複数報告されていますが、本稿ではその現状をごく簡単に紹介します。そもそもAIとは人間の知的活動と類似したタスクを実行するコンピューターシステム全般を示す用語です(図1)。機械学習(Machine Learning)はAIに内包される概念の一つであり、多数のデータから何らかのパターンを学習し回帰・分類等の予測モデルを構築する手法です。深層学習(Deep Learning)は機械学習のうち、多層のニューラルネットワークを用いて階層的な特徴抽出を行う手法で、画像認識・自然言語処理など複雑なタスクに対しても高い効果が得られています。
近年の化学物質の毒性予測においても、高精度な予測を実現するために深層学習手法が取り入れられています。深層学習による毒性予測のアプローチを概説すると、化学物質の構造(特にSMILES等の線形表記)あるいは諸性質を入力データとし、その化学物質が毒性(肝毒性や遺伝毒性など)を有する確率を出力する、という事になります(図2)。前臨床段階の毒性予測の興味深い例として2023年11月にnature communicationsで報告されたAnimalGANがあります1)。AnimalGANは生成型敵対ネットワークモデルを用いOpen TG-GATEs(複数の用量・時間で170種類の化合物に曝露されたラットの肝臓・腎臓トキシコゲノミクスデータと病理組織・血液生化学の大規模公開データベース)2)を学習し、入力された化合物構造情報から動物実験で得られるような多次元毒性プロファイルを予測する事に成功しました。
深層学習に必要な大規模データセットにはこのように公開データベースを用いる事が多いですが、実際の創薬研究では毒性が発現した物質の多くは公知情報とはならず各企業内の秘匿データとなり学習に用い辛い事が課題です。これに対し、MELLODDY(Machine Learning Ledger Orchestration for Drug Discovery)コンソーシアム3)では分散化されたデータソースによる個別学習を組み合わせ機械学習モデル全体の性能を向上させる連合学習と呼ばれる手法を取る事で、各企業のin-houseデータの秘匿性を保ちつつデータセットの共有に成功しています。
以上のように、大規模データベースと深層学習を用いた毒性予測手法は日進月歩的に開発されており、実験動物数の削減や創薬研究の加速に貢献が期待されています。一方、課題としてこれらの多くは低分子化合物のみを標的としている事、「新奇性」の高い化合物への外挿性について信頼性が低い事が挙げられます。いずれにしてもAI分野の開発競争スピードは目を見張るばかりであり、今後の進展に注視する必要があります。
引用文献:
- 1)
- Xi, C., Ruth, R., Zhichao, L. and Weida, T. (2023): A generative adversarial network model alternative to animal studies for clinical pathology assessment. Nat. Commun., 14, 7141.
doi: 10.1038/s41467-023-42933-9 - 2)
- Life Science Databese Archive, Open TG-GATEs
https://dbarchive.biosciencedbc.jp/en/open-tggates/desc.html - 3)
- Machine Learning Ledger Orchestration for Drug Discovery
https://www.melloddy.eu/

図1. AI、機械学習、深層学習の階層関係図。背景画像はChat-GPT4を通してDALL-E3 で作成した。
図2. 化学物質構造を用いた副作用予測深層学習モデルの模式図。ニューラルネットワークの模式図および活性化関数はChat-GPT4を通してMatplotlibで作成した。ここではSMILESで入力した化学物質構造から物性値を計算し中間層(隠れ層)に入力、シグモイド関数を活性化関数とする各ノードの出力から副作用を予測するニューラルネットワークとした。このモデルに大量の化学物質構造-副作用データセットを学習させる事で構造から副作用の予測が可能となる。
2024年 北里大学獣医学部獣医学科 毒性学研究室
武田 一貴
New approach methodsを用いた発達神経毒性アッセイの国際動向
New approach methods(NAMs)は、“実験動物の使用を避けて、化学物質の有害性とリスク評価に関する情報を提供するために使用できる、in silico、in chemicoおよびin vitroの技術、方法論、アプローチ、またはそれらの組み合わせ”を意味する言葉として、2018年に米国Environment Protection Agency(EPA)により提唱され、今では広く使用されるようになってきました。経済協力開発機構(Organisation for Economic Co-operation and Development; OECD)は、化学物質の発達神経毒性評価におけるNAMsの導入を積極的に検討しています。
発達神経毒性(Developmental Neurotoxicity; DNT)は、胎生期もしくは生後発達期の重金属や化学物質等のばく露により、神経系の構造や機能の発達を妨げられる有害な影響です1,2)。基本的な神経発達過程には、神経前駆細胞の増殖、神経細胞やグリア細胞への分化、遊走、アポトーシス、軸索や樹状突起の伸長、髄鞘形成、シナプス形成、機能的神経ネットワークの形成などが含まれています(図1)。OECDが検討しているin vitroアッセイは、“試験管内でこれらの神経発達過程の1つ以上に影響を及ぼす化学物質は、体内でも影響を及ぼす可能性がある”という仮定に基づいています3-5)。図2は、アッセイを主要な神経発達過程ごとに整理したものであり、2024年7月時点で計17アッセイとなっています。17アッセイのうち、医薬品の神経毒性評価法としても近年活用されている微小電極アレイ(MEA)法が、神経機能(電気活動)のアッセイとして採用されました。このアッセイはラット初代大脳皮質ニューロンを用いたプロトコルが記載されていますが、ヒトiPS細胞由来大脳皮質ニューロンを用いた評価法も検討されており、2023年に農薬関連化合物の結果が報告されています6,7)。今後5年間で、DNT in vitro battery(IVB)の専門員が中心となり、アッセイの絞り込みや追加、化合物の曝露方法、ヒト由来細胞の選定などがDNT国際会議にて議論される予定です。現在は詳細なプロトコルの文書化を進め、データを蓄積するとともに、新規評価法の導入も含めて議論をしている段階ですが、今後、各アッセイ成績を基に規制導入に向けた議論が進むものと期待されます。
引用文献:
- 1)
- Mileson, B.E. and Ferenc, S.A. (2001): Methods to identify and characterize developmental neurotoxicity for human risk assessment. Environ. Health. Perspect., 109 Suppl 1, 77-78.
doi: 10.1289/ehp.01109s177 - 2)
- USEPA (1998): Health Effects Guidelines: OPPTS 870.6300 Developmental Neurotoxicity Study.
https://www.epa.gov/test-guidelines-pesticides-and-toxic-substances/series-870-health-effects-test-guidelines - 3)
- Lein, P., Silbergeld, E., Locke, P., and Goldberg, A.M. (2005): In vitro and other alternative approaches to developmental neurotoxicity testing (DNT). Environ. Toxicol. Pharmacol., 19, 735-744.
doi: 10.1016/j.etap.2004.12.035 - 4)
- Lein P., Locke, P., and Goldberg, A. (2007): Meeting report: alternatives for developmental neurotoxicity testing. Environ. Health. Perspect., 115, 764-768.
doi: 10.1289/ehp.9841 - 5)
- Radio, N.M. and Mundy, W.R. (2008): Developmental neurotoxicity testing in vitro: models for assessing chemical effects on neurite outgrowth. Neurotoxicology, 29, 361-376.
doi: 10.1016/j.neuro.2008.02.011 - 6)
- Bartmann, K., Bendt, F., Dönmez, A., Haag, D., Keßel, H.E., Masjosthusmann, S., Noel, C., Wu, J., Zhou, P. and Fritsche, E. (2023): A human iPSC-based in vitro neural network formation assay to investigate neurodevelopmental toxicity of pesticides. ALTEX, 40, 452–470.
doi: 10.14573/altex.2206031 - 7)
- Ishibashi, Y., Nagafuku, N., Kanda, Y. and Suzuki, I. (2023): Evaluation of neurotoxicity for pesticide-related compounds in human iPS cell-derived neurons using microelectrode array. Toxicol. In Vitro, 93, 105668.
doi: 10.1016/j.tiv.2023.105668 - 8)
- Aschner, M., Ceccatelli, S., Daneshian, M., Fritsche, E., Hasiwa, N., Hartung, T., Hogberg, H.T., Leist, M., Li, A., Mundi, W.R., Padilla, S., Piersma, A.H., Bal-Price, A., Seiler, A., Westerink, R.H., Zimmer, B. and Lein, P.J. (2017): Reference compounds for alternative test methods to indicate developmental neurotoxicity (DNT) potential of chemicals: example lists and criteria for their selection and use. ALTEX, 34, 49-74.
doi: 10.14573/altex.1604201 - 9)
- Crofton, K.M. and Munday, W.R. (2021): External scientific report on the interpretation of data from the developmental neurotoxicity in vitro testing assays for use in integrated approaches for testing and assessment. EFSA Supporting Publications, 18, 6924E.
doi: 10.2903/sp.efsa.2021.EN-6924
図1. 基本的な神経発達過程
Aschnerらが提案した基本的な神経発達過程を示している。はじめに、神経幹細胞(NSC、緑色 )が増殖し、神経前駆細胞(薄紫色)やグリア前駆細胞(オレンジ色)を含む複数の種類の神経前駆細胞(NPC)に分化する。これらの細胞は増殖、そして移動し、ニューロン(紫)とグリア(黄色)に分化する。細胞が成熟すると、神経突起が伸びてシナプス(赤色)が形成される。余った細胞はアポトーシスを起こす(灰色)。これらの事象が協調して起こると、細胞間の相互作用により機能的な神経ネットワークを形成する(オリーブ色)。*Aschner M, Ceccatelli S et al. 2017. 8)より掲載
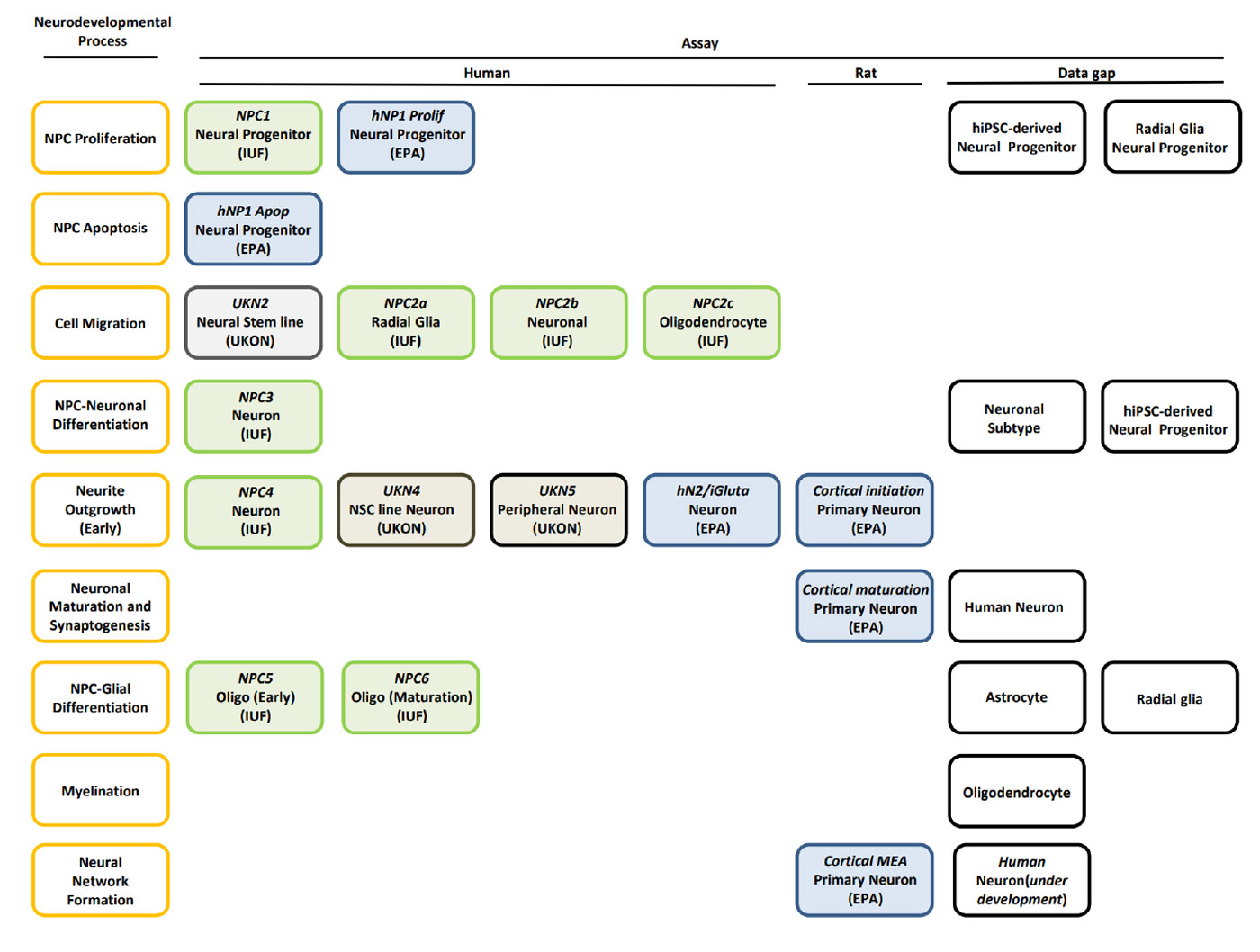
図2. 現在のDNT IVB(Developmental neurotoxicity in vitro battery)における17アッセイ
評価される神経発達過程(行)と使用されるアッセイ(緑色、灰色、および青色カラムの列)。更なる開発が必要で、現在のDNT IVBに含まれていないアッセイは、データギャップとして記載されている。各アッセイは、試験法名(イタリック体)、試験システム(使用された細胞タイプ)、開発者の所属機関[IUF = Leibniz Research Institute for Environmental medicine(緑色); UKON = University of Konstanz(灰色); EPA = US Environmental Protection Agency(青色)]の順で記載されている。
*Crofton KM, and Mundy WR. 2021. 9)より掲載
2024年 東北工業大学 大学院工学研究科
鈴木 郁郎
OECD (Q)SAR評価フレームワーク(QAF)ガイダンス
化学物質の安全性評価において、動物実験の代替法が国際的に注目されています。規制当局が代替法を受け入れるには、科学的妥当性を考慮する原則が必要です。(Q)SAR((Quantitative) Structure Activity Relationship)は、このような代替法の一つであり、化学物質の構造と生物学的活性の関係をモデル化し、未知の化学物質の活性を予測する方法です。OECD (Q)SAR評価フレームワーク(QAF)ガイダンスは、(Q)SARモデルとモデルによる予測結果を考慮する際の規制当局向けガイダンスです1,2)。
(Q)SARを規制当局における安全性評価で活用するためには、モデルの科学的妥当性と性能を検証する必要があります。OECDは2004年に「(Q)SARモデル5原則」3)を、続いて2007年に「(Q)SARモデルの検証に関するガイダンス」4)を発表し、以降、(Q)SARはICH-M7ガイドラインにおける医薬品不純物の変異原性評価5)、OECDの皮膚感作性試験のDefined Approachに関するガイドライン6)に基づく評価、欧州のREACH規則7)における評価など、様々な規制に適用されてきました。しかし、同ガイダンスに基づいて検証された(Q)SARモデルでも、条件によっては受け入れられない予測結果が生成されることがわかってきました。そのため、規制当局において(Q)SARを使用する際は、モデルの検証だけでなく、得られた予測結果も評価する必要があります。OECDは2023年にQAFガイダンスを公開し1)、「(Q)SARモデル、予測結果、および複数の予測から導かれる結果を、規制における安全性評価で活用するための汎用的な評価フレームワーク」を提供しています。
QAFガイダンスにおけるモデルの評価はOECD (Q)SARモデル5原則に基づいています。さらに、規制の現場で専門家が(Q)SARの予測結果を評価してきた長年の経験から、QAFガイダンスでは新しく、OECD (Q)SAR予測4原則(モデルへの入力が正しいこと、モデルが適用範囲内にあること、信頼できる予測であること、規制目的に適した出力であること)を確立しました。これらの原則に基づいて(Q)SARを効率的に評価するため、各原則をさらにいくつかの評価要素に分割しています。
評価は3つのチェックリスト(モデルチェックリスト、予測チェックリスト、結果チェックリスト)を使用して行われます。モデルチェックリストは、(Q)SARモデル5原則に従ってモデルを評価するものであり、個々の評価要素を満たすかどうかを判断し、最終的な受け入れ可能性を結論づけます。予測チェックリストは(Q)SARによる個々の予測を、結果チェックリストは複数の(Q)SAR予測を統合して導かれた総合的な予測結果を、(Q)SAR予測4原則に従って評価するために使用します。この予測ならびに結果チェックリストでは、評価要素ごとに重み付けと不確実性を加味して、最終的な結論を導きます。
QAFガイダンスを使用することで、評価者は(Q)SARの有効性について、一貫性と透明性を持って評価でき、モデル開発者と(Q)SAR実施者が満たすべき要件が明確になります。モデルと予測結果について、チェックリストを用いた評価事例がいくつか作成され、OECDのウェブサイトから公開されています8)。ただし、QAFガイダンスを実際に活用していくためには課題もあります。まず、陰性予測や複数のモデルによる矛盾した予測結果など、現実的な条件を想定したさらなる事例の蓄積が必要となります。また、QAFガイダンスは汎用性と一般性を重視しているため、個別の規制にそのまま用いることはできません。個別の規制と対象とするエンドポイント等に特化したガイダンスやチェックリストを定めることにより、規制申請における個々の(Q)SAR予測結果の使用や、規制当局によるそれらの受け入れが促進されることが期待されます。
QAFガイダンスの考え方は、NAM (New Approach Methodology) を用いた化学物質の有害性評価のための動物実験の削減および代替に向けた世界的な取り組みにも貢献すると考えられます。NAMの規制受け入れにおいて重要なことは、規制上の関心のある特性に関する信頼できる情報を提供し、意図された目的に適合していることを保証することです。この点から、QAFガイダンスでの原則、評価要素、および各評価要素の評価基準は、NAMの適用基準などに拡張できる可能性があります2)。
なお、QAFガイダンスの和訳は日本動物実験代替法評価センター(JaCVAM)より公開されています9)。
引用文献:
- 1)
- OECD (Organisation for Economic Co-operation and Development), (Q)SAR Assessment Framework: Guidance for the regulatory assessment of (Quantitative) Structure-Activity Relationship models, predictions, and results based on multiple predictions, Second Edition, OECD Series on Testing and Assessment, in: No 405, OECD Publishing, Paris, 2024. Accessed August 27, 2025.
https://www.oecd.org/en/publications/q-sar-assessment-framework-guidance-for-the-regulatory-assessment-of-quantitative-structure-activity-relationship-models-and-predictions-second-edition_bbdac345-en.html - 2)
- Gissi, A., Tcheremenskaia, O., Bossa, C., Battistelli, C.L. and Browne, P. (2024): The OECD (Q)SAR Assessment Framework: A tool for increasing regulatory uptake of computational approaches. Comput. Toxicol., 31, 100326.
https://doi.org/10.1016/j.comtox.2024.100326 - 3)
- OECD (Organisation for Economic Co-operation and Development), The report from the expert group on (Quantitative) Structure-Activity Relationships [(Q)SARs] on the principles for the validation of (Q)SARs, OECD Series on Testing and Assessment, No, 49, OECD Publishing, Paris, 2004. Accessed August 27, 2025.
https://one.oecd.org/document/ENV/JM/MONO(2004)24/en/pdf - 4)
- OECD (Organisation for Economic Co-operation and Development). Guidance document on the validation of (Quantitative) Structure-Activity Relationship [(Q)SAR] models. OECD Series on Testing and Assessment, No. 69, OECD Publishing, Paris, 2007. Accessed August 27, 2025.
https://www.oecd.org/en/publications/guidance-document-on-the-validation-of-quantitative-structure-activity-relationship-q-sar-models_9789264085442-en.html - 5)
- 医薬品医療機器総合機構. ICH M7 潜在的発がんリスクを低減するための医薬品中DNA反応性(変異原性)不純物の評価及び管理ガイドライン. Accessed August 27, 2025.
https://www.pmda.go.jp/int-activities/int-harmony/ich/0036.html - 6)
- OECD (Organisation for Economic Co-operation and Development). Guideline No. 497: Defined Approaches on Skin Sensitisation. OECD Guidelines for the Testing of Chemicals, Section 4, OECD Publishing, Paris, 2023. Accessed August 27, 2025.
https://www.oecd.org/en/publications/guideline-no-497-defined-approaches-on-skin-sensitisation_b92879a4-en.html - 7)
- ECHA (European Chemicals Agency). REACH (Registration, Evaluation, Authorisation and Restriction of Chemicals) Legislation. Accessed August 27, 2025.
https://echa.europa.eu/regulations/reach/legislation - 8)
- OECD (Organisation for Economic Co-operation and Development) website. QAF checklist example. Accessed August 27, 2025.
https://www.oecd.org/en/events/2023/11/qsar-assessment-framework-guidance-for-assessing-qsar-models-and-predictions.html - 9)
- JaCVAM (Japanese Center for the Validation of Alternative Methods) website. OECD (Q)SAR Assessment Framework (Q)SAR評価の枠組み:定量的構造活性相関モデル、予測および複数の予測から導かれる結果の規制評価のためのガイダンス 第2版(翻訳版). Accessed August 27, 2025.
https://www.jacvam.go.jp/sar.html
2025年 国立医薬品食品衛生研究所 安全性生物試験研究センター
山田 隆志、丸山(薦田) 多恵子、古濱 彩子
毒性オミクス
ゲノム時代と創薬への過剰な期待
世の中は今やゲノム時代である。“Gene”と“Chromosome”を組み合わせた造語である"Genome"はライフサイエンスを制覇した。近年のゲノム研究とナノサイエンスの進歩は日ごとに目覚ましいものがある。加えて、最新解析機器の進歩と相まってこれまで見えないものの正体がようやく見えてきた。見えないものには好奇心と関心が払われるが、見えてしまうとさらにその先の見えないものに向かって研究が推進されるのは世の常である。科学が進歩することにより人類、研究者は多くの恩恵を受けるが、同時にそれ以上の宿題が課せられ、場合によっては混乱を招くことも少なくない。ゲノム科学の進歩は正にその端的な例である。
2003年4月14日にヒトゲノム完全解読が公表された。その時の各国の国際プロジェクトへの貢献度は、アメリカ59%、イギリス31%、日本6%、フランス3%、ドイツ1%、中国1%であった。日本がアメリカに大きく溝をあけられた原因にはいろいろなことが挙げられている。例えば、出発点ではアメリカを凌いでいたにも関わらず、その敗因として当時の国策が総じて小出しで遅すぎたことが指摘されている。事実、和田昭允の卓越した先見性と日立製作所の優れた技術により米国に先駆けて製作されたDNAシークエンサーは、その後の米国の官民一体の強力な追い込みによりいとも簡単に追い越された。また、我が国ではポストゲノムの促進を目指して1998年に「大学等技術移転促進法」が制定されたが、そのときにはアメリカではすでに知的戦略が国内の隅々まで浸透していた。これらの例で明らかな様に、日本政府の後手後手の戦略が目立つ。
米国は2002年にNIHと国立ヒトゲノム研究センター(NHGRI)がエンコード計画を発表した。これは、”Encyclopedia of Human DNA Elements”であり、正に遺伝情報の意味を解き明かしてゲノムの百科辞典をつくる計画である。我が国では、ヒトゲノム解読の敗北を教訓として、その巻き返しのために、ポストゲノムにかけて産学官の総力で2002年度に「タンパク3000」の5年間の国家プロジェクトが理研と大学の共同作業でスタートした。毎年1700億円の科学研究費補助金がどこに消えているのか、その有効活用が気になるところである。
いまや、ライフサイエンスやナノサイエンスなどの有力な研究室には最先端の計測分析機器が整備されている。その多くは外国製である。かつて、私が教職にあった1985年頃に、当時の中曽根内閣が我が国の貿易黒字を減らすために、外国製大型機器の購入には優先的に予算を付けるなど半ば強制的に米国製機器を購入した時期があった。さらに、米国留学から帰った我が国の研究者は、米国製の機器を好んで購入した。それにより、国内における先端機器開発の遅れによるバイオサイエンスでの日米の格差が歴然となった。その結末は国産品の開発や使用の遅れとなり、ひいては我が国から発信する科学技術の低落に繋がった。
かつて欧米で始められたコンピューター上でのバーチャル創薬は、彼等が期待した程の成果はみられなかったことから、多くの研究者はそれから撤退した。また、一時期米国の医療分野で花盛りであった遺伝子治療も、数年の経験の結果予想したほどの成果が得られずベクターの開発に留まったことから、米国では一部の有効例を除いて多くの研究者はそれから手を引いた。日本ではどうだろうか。日本人は新しい情報、技術には極めて敏感に反応しそれを取り入れる。しかし、それが期待した程の成果が得られないことがわかっても、中々踏ん切りをつけることが出来ない。遺伝子診断は多くの成果が挙げられているが、遺伝子治療は期待したほどでもないにも関わらず、わが国では国策として今もって続いている。
私は昨今のゲノム研究の成果が新薬開発に向けられていることに大きな期待と同時にある種の懸念をもっている。ヒトゲノム解読の結果明らかになった30億個の塩基と、3.5~4万個の遺伝子が10万—20万種類のタンパク質をつくるとなれば、遺伝子配列だけでタンパク質の機能を推定するのは難しい。それは、一つの遺伝子が複数のタンパク質を合成することとなり、タンパク質同士の相互作用で複雑なバリエーションが生まれることが考えられる。さらに、発見された遺伝子の中で、その機能が明確なものは全体の僅か10%に過ぎない。つまり、個人レベルで考えるならば、in vivo における薬物応答phenotypeとin vitroから誘導されるgenotype情報をどのように関連づけるかが問題である。これがなされない限り、ゲノム情報がそのまま新薬の開発には結びつきにくいという事実がある。その橋渡しがBioinformaticsの有用性であり、機能が明らかでない遺伝子は、proteomicsの研究成果によりそのタンパク質の機能が明確となる。そこで初めてゲノム創薬のレールが敷かれることとなる。
ここで誤解を避けるためにあえて強調したいのは、ゲノム研究の成果は、医薬品開発の各ステップには大きな利益をもたらしていることは間違いない。例えば、SNPの技術による遺伝子解析の成果は、いわゆる“テーラーメード医療”として、いろいろな問題はあるにしろ今後臨床試験で役立つことが期待される。また、Toxicogenomicsの進歩によるsafety evaluationの進歩は異論のないところである。High Throughput Screening による膨大なdrug candidatesのscreeningはまさにゲノム技術の恩恵によるところが大きい。さらに、市販後における重篤な副作用の解析にゲノム技術は不可欠ともいわれている。今後OMICSの研究により多くの有益な情報をもたらすことは疑いない。これらのゲノム技術を創薬の中に取り入れた医薬品開発をいわゆる「ゲノム創薬」と呼ぶのであれば、それはそれなりに成功しているとみてよい。その意味では、大学における研究もゲノム創薬の一部を担っていると考えてよい。問題は、「ゲノム創薬」のイメージが個人により異なるところに混乱を招く原因かがある。
国立大学も最近では独立法人化され経営の効率化が大きな争点となっているが、医薬産業はあくまでも営利事業であるので、それに対するCost-Benefit Balance, Cost-Performance Balanceが問題となる。ゲノム創薬を遂行するための莫大な先行投資と、それによりもたらされる新薬の収益とのバランスが果たして許容できる範囲だろうか。私はこれに関して何ら数字上の情報を持っていないので的外れな危惧かもしれない。しかし、もし、世の中の人々が、ゲノム創薬により短期間の間に低コストで多くの新薬が開発される「打ち出の小槌」であると考えるならば、それは余りにも大きな期待を与えることとなる。現に、海外の大手の製薬企業でさえいわゆる「ゲノム創薬」による新薬はまだ上市されていないと聞く。
ゲノム創薬は近代の輝かしいサイエンスに違いない。また、薬物療法へのゲノム科学の導入はいわゆる「テーラーメード治療」に代表されるかもしれない。しかし、これが一般市民の治療に益をもたらすためには、医療保険制度の改正などサイエンス以外の部分で多くの問題が山積している。サイエンスは世の中に多くの幸せをもたらすが、同時に多くの混乱を招くことも少なくない。私は創薬の場の経験がないので、もし本稿の内容がすベて現状を理解していないものとされるならば、自分の浅学を恥じるものである。いずれにしても、世の中にあふれているゲノム情報を是非患者に役立つ形で還元して欲しいものである。
2010年 千葉大学名誉教授
佐藤 哲男
リスクアセスメント・リスクマネージメント
一日曝露許容量(Permitted Daily Exposure:PDE)設定における毒性研究者の役割
医薬品製造現場においては、次に製造される医薬品への混入(交叉汚染)防止や製造物質の曝露から作業者を保護する観点から、医薬品ごとに残留あるいは作業者曝露の限度値を設定することが必要です。2021年に国内GMP省令が改正され、その公布通知において毒性学的根拠に基づいてPDE等の限度値を設定することが要求されています1)。そのため、今後、医薬品製造現場における限度値設定にあたって毒性研究者が関与する機会が増えることが想定されます。毒性学的根拠に基づくPDE設定の方法としては、2018年にPIC/S(医薬品査察協定・医薬品査察協同スキーム)から発効されたHBEL(健康に基づいた曝露限度値)設定ガイドラインやICH Q3C医薬品の残留溶媒ガイドライン等が参考となります2, 3, 4)。対象は異なるものの、WHOや食品安全委員会で行われる食品添加物、農薬や環境汚染物質等のADI(一日許容摂取量)やTDI(一日耐容摂取量)の設定方法とも毒性学的根拠に基づく点で共通しています。
PDE設定の流れの1例を図に示します3)。PDEを設定するためには、まず、非臨床及び臨床試験を含む全ての関連データから有害性を特定し、ヒトの健康に重大な影響を及ぼす所見を見極め、起点(POD)となるNOAEL(無毒性量)あるいはNOEL(無影響量)等を選択します。次に、様々な不確実性(種差、個体差、試験期間、作用の重篤性、NOELの外挿)に対応する調整係数(F1~F5)を毒性学的判断に基づいて設定します。基本的なPDE設定の流れは図の通りですが、医薬品ごとに有する試験の種類やデータは異なります。そのため、広範囲のデータを基にケースバイケースでPODや調整係数を選定するためには、薬理学や毒性学の知識とともにPDE設定の経験が重要です。
PDE設定が医薬品開発における毒性評価と異なる点として、薬理作用も有害作用とみなされる点が挙げられます。その理由は、交叉汚染でも作業者曝露でも、他疾患の患者や作業者が当該医薬品を意図せずに摂取してしまう可能性を考慮しなければならないためです。
以上、医薬品製造現場において適切な交叉汚染防止及び作業者保護を実施するためには、PDE設定は必要不可欠であり、毒性研究者の役割が非常に重要です。各社においてPDEが適切に設定されるためには、設定者である毒性研究者の知識や経験の向上が必要不可欠であり、PDE設定に関する教育環境の整備と情報共有の場が求められます。
引用文献:
- 1)
- 医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の一部改正について.厚生労働省医薬・生活衛生局監視指導・麻薬対策課長通知(令和3年4月28日薬生監麻発0428第2号)
- 2)
- PIC/S (2018): Guideline on setting health based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities (PI 046-1 Annex, 1 July)
- 3)
- PDE設定検討会 (2021):ゼロから学ぶHBEL! 共用施設における医薬品の交叉汚染防止のためのPDE設定 出版社:じほう ISBN: 978-4-8407-5411-8
- 4)
- ICH Q3C(R8) 「Impurities: Guideline for Residual Solvents」 Appendix 3, 2021年4月22日

2023年 キッセイ薬品工業株式会社 安全性研究所
黒岡 貴生
実験動物
動物試験における環境エンリッチメント
動物試験を実施する上で動物福祉に配慮すること、すなわち実験動物を適正に取り扱いウェルビーイングを向上させることが求められています。ウェルビーイングの向上により動物のストレス反応を抑制して信頼性、再現性の高い試験データを得ることが期待されます。そのためには、動物試験が3Rs(Reduction, Replacement, Refinement)や動物の5つの自由(5 freedoms; Freedom from Hunger and Thirst, Freedom from Discomfort, Freedom from Pain, Injury or Disease, Freedom to Express Normal Behavior, Freedom from Fear and Distress)に基づいて実施されることが必要です。3Rsの中のRefinementの向上として、飼育環境を富化する環境エンリッチメント(以下エンリッチメント)が幅広く利用されるようになりました。
エンリッチメントは、動物福祉の観点から飼育動物の生活環境を改善して本来の生態環境に近づける具体的な方策で、実験動物飼養保管等基準解説書に「実験目的の達成に支障のない範囲で提供した条件で飼育することが望ましい」と記載されています1)。ILAR guide 8th eds.の中でも動物のウェルビーイングを向上させるためにエンリッチメントの利用が推奨され、米国においてエンリッチメントプログラムを有する施設は2007年の報告では20-40%でしたが、2013年には75-90%まで高まっていました2-4)。
エンリッチメントには様々なアプローチがあり(図1)、Physical(動物種に配慮した飼養空間提供等)、Social(動物間で交流できるグループ飼育等)、Occupational/Cognitive(運動機会の提供等)、Sensory(巣材、映像等の提供)及びFood-related(餌探索行動時間の延長等)に分類できます。近年エンリッチメントの動物への影響に関する研究成果(認知機能向上、探索行動増加、不安行動抑制、糖質コルチコイド濃度減少等)が多く報告されています5-10)。
動物試験におけるエンリッチメント利用にあたっては、動物の行動や生理への影響等を確認して、動物種や実験目的に沿った種類や利用法を評価・検討すること、科学・福祉・実務のバランスのとれたエンリッチメントを選択・使用することが重要と考えられます。
引用文献:
- 1)
- 環境省自然環境局総務課動物愛護管理室編, 実験動物飼養保管等基準解説書研究会著.(2017): 実験動物の飼養及び保管並びに苦痛の軽減に関する基準の解説, pp.48,アドスリー, 東京.ISBN: 978-4-904419-72-4
- 2)
- National Research Council.(2011):Guide for the care and use of laboratory animals, 8th ed., pp.52-54, The national academies press, Washington, D.C.
doi: 10.17226/12910 - 3)
- Silverman, J., Suckow, M.A. and Murthy, S.T. (Eds.). (2007): The IACUC HANDBOOK 2nd ed., pp.521-542, CRC press, NW. ISBN: 978-0849340109
- 4)
- Silverman, J., Suckow, M.A. and Murthy, S. T. (Eds.). (2013): The IACUC HANDBOOK 3rd ed., pp.657-684, CRC press, NW. ISBN: 978-1466555648
- 5)
- Sampedro-Piquero, P., Begega, A., Zancada-Menendez, C., Cuesta, M. and Arias, J.L. (2013): Age-dependent effects of environmental enrichment on brain networks and spatial memory in Wistar rats. Neuroscience. 248:43-53.
doi: 10.1016/j.neuroscience.2013.06.003 - 6)
- Goes, T.C., Antunes, F.D. and Teixeira-Silva, F. (2015): Environmental enrichment for adult rats: Effects on trait and state anxiety. Neurosci. Lett. 584:93-96.
doi: 10.1016/j.neulet.2014.10.004 - 7)
- Kirkpatrick, K., Marshall, A.T., Smith, A.P., Koci, J. and Park, Y. (2014): Individual differences in impulsive and risky choice: effects of environmental rearing conditions. Behav. Brain. Res. 269:115-127.
doi: 10.1016/j.bbr.2014.04.024 - 8)
- Wolf, S.A., Kronenberg, G., Lehmann, K., Blankenship, A., Overall, R., Staufenbiel, M. and Kempermann, G. (2006): Cognitive and physical activity differently modulate disease progression in the amyloid precursor protein (APP)-23 model of Alzheimers disease. Biol. Psychiatry. 60:1314–1323.
doi: 10.1016/j.biopsych.2006.04.004 - 9)
- Fox, C., Merali, Z., Harrison, C. (2006): Therapeutic and protective effect of environmental enrichment against psychogenic and neurogenic stress. Behav. Brain Res. 175:1–8.
doi: 10.1016/j.bbr.2006.08.016 - 10)
- Koyama, H., Tachibana, Y., Takaura, K., Takemoto, S., Morii, K., Wada, S., Kaneko, H., Kimura, M. and Toyoda, A. (2019): Effects of housing conditions on behaviors and biochemical parameters in juvenile cynomolgus monkeys (Macaca fascicularis). Exp Anim. 68:195-211.
doi: 10.1538/expanim.18-0114

2023年 株式会社ケー・エー・シー 技術推進部
小山 公成
